题目内容
【题目】(1)990C时,Kw=1.0×10-12mol2·L-2,该温度下测得0.1 mol·L-1 Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为______________________.
②该温度下,将0.01 mol· L-1 H2A溶液稀释到20倍后,溶液的pH=________。
③体积相等、pH均为1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气______(填字母)
A.盐酸多 B.H2A多 C.一样多 D.无法确定
(2)最新研究发现,用隔膜电解法处理高浓度乙醛废水的工艺具有流程简单、能耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应生成乙醇和乙酸,总反应式为2CH3CHO+H2O![]() CH3CH2OH +CH3COOH实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。
CH3CH2OH +CH3COOH实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。

①若以甲烷碱性燃料电池为直流电源,则燃料电池中b极应通入_______(填化学式),电极反应式为_______。
②在实际工艺处理中,阴极区乙醛的去除率可达80%。若在两极区分别注入1m3乙醛含量为3000mg·L-1的废水,可得到乙醇_____kg(计算结果保留小数点后1位)
【答案】 H2A=2H+ + A2- 3 C CH4 CH4+10OH- - 8e- =CO32-+7H2O 2.5
【解析】试题分析:(1) ①990C时,Kw=1.0×10-12mol2·L-2,990C时PH=6的溶液呈中性;②该温度下,将0.01 mol· L-1 H2A溶液中氢离子浓度为0.02 mol· L-1,稀释到20倍后,氢离子浓度为0.001 mol· L-1;③盐酸与H2A都是强酸,体积相等、pH均为1的盐酸与H2A溶液氢离子的物质的量相同。(2)①根据装置图,Na+移向d电极,说明d是阴极,则b是负极;②电解池阴极发生还原反应,阴极的电极反应为![]() ,根据电极反应计算乙醇的产量。
,根据电极反应计算乙醇的产量。
解析:(1) ①990C时,Kw=1.0×10-12mol2·L-2,所以990C时PH=6的溶液呈中性,0.1 mol·L-1 Na2A溶液的pH=6,说明H2A是强酸, H2A在水溶液中的电离方程式为H2A=2H+ + A2-;②该温度下,将0.01 mol· L-1 H2A溶液中氢离子浓度为0.02 mol· L-1,稀释到20倍后,氢离子浓度为0.001 mol· L-1,PH=![]() =3;③盐酸与H2A都是强酸,体积相等、pH均为1的盐酸与H2A溶液氢离子的物质的量相同,与足量的Zn反应,产生的氢气一样多。
=3;③盐酸与H2A都是强酸,体积相等、pH均为1的盐酸与H2A溶液氢离子的物质的量相同,与足量的Zn反应,产生的氢气一样多。
(2)①根据装置图,Na+移向d电极,说明d是阴极,则b是负极,甲烷碱性燃料电池b极应通入的是CH4;b电极反应式为CH4+10OH- - 8e- =CO32-+7H2O;
②1m3乙醛含量为3000mg·L-1的废水含有乙醛的质量为3Kg,设生成乙醇的质量为xg
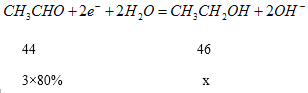
![]()
x=2.5Kg