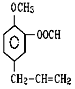
题目内容
【题目】根据下图所示各装置和实验室制取氧气的原理,回答下列问题:
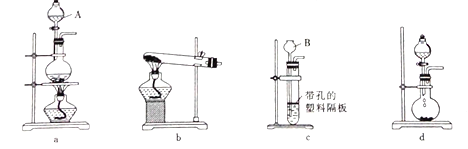
(1)仪器A、B的名称分别为_____、_________。
(2)用mgMnO2和n g KC1O3组成的固体混合物加热制取氧气时,可选用的实验装置是_____(填装罝序号)。
(3)将MnO2和KC1O3的混合物充分加热至不再产生氧气时,若要将其中的催化剂MnO2回收再利用,应进行的实验操作是将固体冷却、加水溶解、______、洗涤、干燥;洗涤MnO2固体的操作方法为_______________________。证明MnO2固体已洗涤干净的操作方法为____________________。
(4)将(2)中的固体混合物加热一段时间,冷却后称得剩余固体质祯为p g,则当(m+n+p):n=___时,表明KC1O3已完全分解。
(5)用双氧水和MnO2制取氧气时,不能选用装置c,其原因是________________。
(6)用装置d制取氨气时,所需的化学药品是 ________________,氨气的电子式为__________。
【答案】 分液漏斗 长颈漏斗 b 过滤 将蒸馏水沿玻璃棒慢慢地注入到过滤器漏斗中至液面浸没滤纸上的固体,待水流尽后重复操作23次 取最后一次洗涤液少许,向其中滴加几滴AgNO3溶液,若无沉淀生成,则证明MnO2固体已洗涤干净 96 : 245 MnO2是粉状固体,不能稳定存在于装置中的塑料隔板之上(或不能控制反应速率) 浓氨水、碱石灰(或浓氨水、生石灰或浓氨水、氢氧化钠固体) ![]()
【解析】(1)如图,A为分液漏斗,B为长颈漏斗。
(2)用MnO2和KC1O3加热制取氧气时,应选用“固+固![]() ”装置,故选b。
”装置,故选b。
(3)将MnO2和KC1O3的混合物充分加热至不再产生氧气时,剩余固体为MnO2和KC1,KC1易溶于水,而MnO2难溶于水,若要将其中的MnO2回收,应进行的实验操作是:将固体冷却、加水溶解、过滤、洗涤、干燥;洗涤MnO2固体的操作方法为:将蒸馏水沿玻璃棒慢慢地注入到过滤器漏斗中至液面浸没滤纸上的固体,待水流尽后重复操作2~3次;证明MnO2固体是否洗涤干净,其实就是检验MnO2固体表面是否有Cl-,操作方法为:取最后一次洗涤液少许,向其中滴加几滴AgNO3溶液,若无沉淀生成,则证明MnO2固体已洗涤干净。
(4)根据反应:
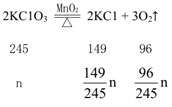
若KC1O3已完全分解,则p=m+ ![]() ,所以(m+n-p):n=96:245。
,所以(m+n-p):n=96:245。
(5)用双氧水和MnO2制取氧气时,不能选用装置c,因为MnO2是粉状固体,不能稳定存在于装置中的塑料隔板之上(或不能控制反应速率)。
(6)用装置d制取氨气时,利用的是NH3H2O受热分解放出氨气,适合于实验室制取少量氨气临时使用,故所需的化学药品是浓氨水和碱石灰,利用碱石灰遇水放出大量热使浓氨水分解放出氨气,所以还可以是:浓氨水和生石灰或浓氨水和氢氧化钠固体;氨气的电子式为:![]() 。
。

 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案【题目】某同学设计计如下图所示装罝(部分夹持装置己略去)进行实验探究:
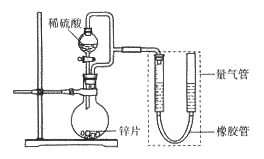
(1)用上述装置探究影响化学反应速率的因素。以生成9.0 mL气体为计时终点,结果为t1>t2。
序号 | V(H2SO4)/mL | C(H2SO4)/mol·L-1 | t/s |
I | 40 | 1 | t1 |
II | 40 | 4 | t2 |
①比较实验I和Ⅱ可以得出的实验结论是_______________。
②若将锌片换成含杂质的粗锌片,其他条件使其与上述一致,所测得的反应速率均大于上述实验对应的数据。粗锌片中所含杂质可能是_________(填序号)。
A.二氧化硅 B.银 C.铜 D.石墨
(2)用上述装置验证生铁在潮湿空气中会发生吸氧腐蚀。
①圆底烧瓶中的试剂可选用________(填序号)。
A.稀HCl B .NaCl溶液 C.乙醇 D.NaOH溶液
②能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是_____________。