题目内容
【题目】某同学设计实验探究构成原电池的条件,装置如图:
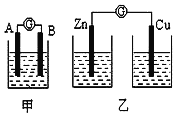
实验一:实验探究电极的构成(甲图)
①A、B两极均选用石墨作电极,发现电流计指针不偏转;②A、B两极均选用铜片作电极,发现电流计指针不偏转;③A极用锌片,B极用铜片,发现电流计指针向左偏转;④A极用锌片,B极用石墨,发现电流计指针向左偏转。
结论一: _________________________________;
实验二:探究溶液的构成(甲图,A极用锌片,B极用铜片)
①液体采用无水乙醇,发现电流计指针不偏转。
②改用硫酸溶液,发现电流计指针偏转,B极上有气体产生;
结论二: __________________________________________;
实验三:对比实验,探究乙图装置能否构成原电池
将锌、铜两电极分别放入稀硫酸溶液中,发现锌片上有气泡产生,铜片上无明显现象,电流计指针不发生偏转.
结论三: _________________________________________ ;
思考:对该同学的实验,同学乙提出了如下疑问,请你帮助解决。
(1)在甲图装置中,若A为镁片,B为铝片,电解质溶液为NaOH溶液;负极为_______(填“A”或“B”);电流计的指针应向_______偏转(填“右”或“左”)。
(2)一根金属丝两端分别放在图乙的两个烧杯之中,电流计指针_______(填“能”或“不能”)偏转。
【答案】电极必须是两活泼性不同的电极 溶液必须是电解质溶液 必须构成闭合回路 B 右 不能
【解析】
实验一:由①②可知,当两极相同时,不能形成原电池;由③④可知,当两极是两种活泼性不同的金属或一种是金属一种是可导电的非金属时,可以形成原电池;
实验二:①中乙醇是非电解质,溶液中无自由移动离子;②中硫酸是电解质,硫酸溶液中有自由移动离子,能形成原电池;
实验三:要有电流,必须能形成闭合回路。
(1)在甲图装置中,若A为镁片,B为铝片,电解质溶液为NaOH溶液,铝与氢氧化钠溶液发生自发的氧化还原反应,所以铝是负极,镁是正极;根据Al与强碱溶液反应分析;
(2) 一根金属丝两端分别放在图乙的两个烧杯之中,不符合原电池的构成条件,电流计指针不能偏转。
实验一:由①②可知,当两极相同时,不能形成原电池;由③④可知,当两极是两种活泼性不同的金属或一种是金属一种是可导电的非金属时,可以形成原电池;
结论一:电极必须是两活泼性不同的电极;
实验二:①中乙醇是非电解质,溶液中无自由移动离子;②中硫酸是电解质,硫酸溶液中有自由移动离子,能形成原电池;结论二:溶液必须是电解质溶液;
实验三:要有电流,必须能形成闭合回路,结论三:必须构成闭合回路。
(1)在图甲装置中,若A 为镁片,B为铝片,电解质溶液为NaOH溶液,由于铝与氢氧化钠溶液发生自发的氧化还原反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,所以铝是负极,镁是正极,根据上述实验,电流计向负极偏转,即向右偏转;
(2)一根金属丝两端分别放在图乙的两个烧杯之中,不符合原电池的构成条件,没有形成闭合回路,因此电流计指针不能偏转。

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案