题目内容
下列叙述不正确的是( )
| A、通过单质Fe与Cl2、S反应的产物可以判断Cl2和S的氧化性强弱 | B、向饱和Ca(OH)2溶液中加入一小块钠,溶液中有固体析出 | C、浓硫酸在常温下能够使铁、铝等金属钝化 | D、干燥的氯气可使湿润的pH试纸退色,说明Cl2具有漂白性 |
分析:A.氯气具有强氧化性,能将铁氧化成+3价的铁,而硫的氧化性较弱,与铁反应生成+2价的铁;
B.氢氧化钙的溶解度随着温度的升高而降低;
C.浓硫酸在常温下能够使铁、铝等金属钝化;
D.干燥的氯气没有漂白性,干燥的氯气可使湿润的pH试纸退色,是因为氯气和水反应生成次氯酸具有漂白性;
B.氢氧化钙的溶解度随着温度的升高而降低;
C.浓硫酸在常温下能够使铁、铝等金属钝化;
D.干燥的氯气没有漂白性,干燥的氯气可使湿润的pH试纸退色,是因为氯气和水反应生成次氯酸具有漂白性;
解答:解:A.氯气具有强氧化性,2Fe+3Cl2
2FeCl3,生成+3价的氯化铁,Fe+S
2FeS,生成+2价的铁,Cl2的氧化性强于S,故A正确;
B.钠和水反应放出大量的热,饱和Ca(OH)2溶液因温度升高,溶解度降低,析出氢氧化钙,故B正确;
C.浓硫酸在常温下能够使铁、铝等金属表面形成致密的氧化膜阻止反应进一步发生,发生钝化,故C正确;
D.干燥的氯气不具有漂白性,氯气与水反应Cl2+H2O?HCl+HClO,生成具有漂白性的HClO,可使湿润的pH试纸褪色,故D错误;
故选D.
| ||
| ||
B.钠和水反应放出大量的热,饱和Ca(OH)2溶液因温度升高,溶解度降低,析出氢氧化钙,故B正确;
C.浓硫酸在常温下能够使铁、铝等金属表面形成致密的氧化膜阻止反应进一步发生,发生钝化,故C正确;
D.干燥的氯气不具有漂白性,氯气与水反应Cl2+H2O?HCl+HClO,生成具有漂白性的HClO,可使湿润的pH试纸褪色,故D错误;
故选D.
点评:本题主要考查了元素化合物有关知识,侧重考查氯、钠及其化合物的性质,平时注意基础知识掌握,题目难度不大.

练习册系列答案
相关题目
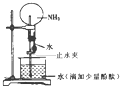 如图是实验室进行氨溶于水的“喷泉实验”的装置,下列叙述不正确的是( )
如图是实验室进行氨溶于水的“喷泉实验”的装置,下列叙述不正确的是( )| A、该实验说明氨气是一种极易溶于水的气体 | B、进入烧瓶中的液体颜色由无色变为红色,说明氨水有碱性 | C、氨水很稳定,将烧瓶中的红色溶液加热,颜色不会发生变化 | D、形成“喷泉”的主要原因是氨气溶于水后,烧瓶内的气压小于大气压 |
苯与乙烯相比较,下列叙述不正确的是( )
| A、都能燃烧,生成二氧化碳和水 | B、都容易发生加成反应 | C、乙烯易发生加成反应,苯只能在特殊条件下才发生加成反应 | D、乙烯易被酸性高锰酸钾溶液氧化,苯不能被酸性高锰酸钾溶液氧化 |