题目内容
某温度下,体积一定的密闭容器中进行如下反应:2X(g)+Y(g) Z(g)+W(s) ΔH>0,下列叙述正确的是
Z(g)+W(s) ΔH>0,下列叙述正确的是
| A.在容器中加入氩气,反应速率不变 |
| B.加入少量W,逆反应速率增大 |
| C.升高温度,正反应速率增大,逆反应速率减小 |
| D.将容器的体积压缩,可增大单位体积内活化分子的百分数,有效碰撞次数增大 |
A
解析试题分析:A、在容器中加入氩气,压强增大,但物质的浓度,所以反应速率不变,A正确;B、W是固体,所以加入少量W,正逆反应速率均不变,B不正确;C、升高温度,正逆反应速率均增大,C不正确;D、将容器的体积压缩,可增大单位体积内活化分子数,有效碰撞次数增大,反应速率加快,但单位体积内活化分子的百分数不变,D不正确,答案选A。
考点:考查外界条件对反应速率的影响

练习册系列答案
相关题目
四个体积相同的密闭容器中在一定的条件下发生反应: 2SO2+O2  2SO3,反应开始时,反应速率由大到小排列顺序正确的是
2SO3,反应开始时,反应速率由大到小排列顺序正确的是
| 容器 | 温度 | SO2(mol) | O2(mol) | 催化剂 |
| 甲 | 500℃ | 10 | 5 | - |
| 乙 | 500℃ | 10 | 5 | V2O5 |
| 丙 | 450℃ | 8 | 5 | - |
| 丁 | 500℃ | 8 | 5 | - |
A.乙>甲>丁>丙 B.乙>甲>丙>丁 C.甲>乙=丁>丙 D.乙>甲>丙=丁
恒温条件下,对于可逆反应A(g)+B(g) C(g)+D(g),加入起始浓度相近的A和B,在达到平衡的过程中可能有三种情况,如下图所示。下列判断中正确的是
C(g)+D(g),加入起始浓度相近的A和B,在达到平衡的过程中可能有三种情况,如下图所示。下列判断中正确的是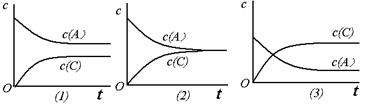
| A.(1)的K<1 | B.(2)的K≈1 | C.(3)的K>1 | D.以上三种可能全对 |
恒温恒容密闭容器中,进行反应A(s)+2B(g) C(g)+D(g),下列能作为化学平衡状态标志的是:①混合气体的密度;②容器内气体的压强;③混合气体总物质的量;④B的物质的量浓度
C(g)+D(g),下列能作为化学平衡状态标志的是:①混合气体的密度;②容器内气体的压强;③混合气体总物质的量;④B的物质的量浓度
| A.①④ | B.②③ | C.②③④ | D.只有④ |
以下实验原理中,不能用勒沙特列原理解释的是
| A.实验室用排饱和食盐水的方法收集氯气 |
| B.用浓磷酸与KBr反应制备HBr气体 |
| C.配制FeSO4溶液时,加入一些铁粉 |
| D.在干燥的HCl气流里加热MgCl2·6H2O晶体,得到无水MgCl2 |
在密闭容器中,放入镍粉并充入一定量CO气体,一定条件下发生反应:Ni(s)+4CO(g)  Ni(CO)4(g),已知该反应在25℃和80℃时的平衡常数分别为5×104和2,下列说法正确的是
Ni(CO)4(g),已知该反应在25℃和80℃时的平衡常数分别为5×104和2,下列说法正确的是
| A.上述生成Ni(CO)4(g)的反应为吸热反应 |
| B.恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动 |
| C.在80℃时,测得某时刻,Ni(CO)4 、CO浓度均为0.5 mol/L,则此时v正<v逆 |
| D.恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,CO 的百分含量将增大 |
t ℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)  2Z(g),各组分在不同时刻的浓度如下表:
2Z(g),各组分在不同时刻的浓度如下表:
| 物质 | X | Y | Z |
| 初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
| 2 min末浓度/mol·L-1 | 0.08 | a | b |
| 平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法正确的是
A.平衡时,X的转化率为20%
B.t ℃时,该反应的平衡常数为40
C.增大平衡后的体系压强, v正增大,v逆减小,平衡向正反应方向移动
D.前2 min内,用Y的变化量表示的平均反应速率v(Y)="0.03" mol·L-1·min-1
已知:(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) △H="74.9" kJ·mol-1,下列说法中正确的是
| A.该反应中熵变、焓变皆大于0 |
| B.该反应是吸热反应,因此一定不能自发进行 |
| C.碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发进行 |
| D.能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应 |
 xC(g) △H<〈0。测得两容器中c(A)随时间t的变化如图所示,下列说法正确的是
xC(g) △H<〈0。测得两容器中c(A)随时间t的变化如图所示,下列说法正确的是