题目内容
【题目】铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。
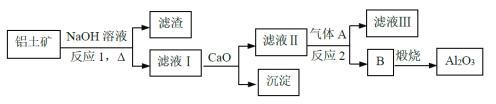
①铝土矿的主要成分是Al2O3和SiO2等。从铝土矿中提炼Al2O3的流程如下:
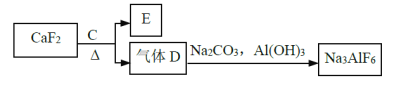
②以萤石(CaF2)和纯碱为原料制备冰晶石的流程如下:
请回答下列问题:
(1)反应1中的化学方程式有2NaOH+SiO2→Na2SiO3+H2O以及___________;
(2)滤液Ⅰ中加入CaO生成的沉淀是_______,反应2的离子方程式为________(气体A过量);
(3)E可作为建筑材料,化合物C是浓硫酸,请写出由D制备冰晶石的化学方程式______;
(4)电解制铝以石墨为电极,请写出阳极的电极反应式____________________。
【答案】Al2O3+2NaOH=2NaAlO2+H2O CaSiO3 NaAlO2+CO2+2H2O=NaHCO3+Al(OH)3 12HF+3Na2CO3+2Al(OH)3![]() 2Na3AlF6+3CO2↑+6H2O O2--4e=O2↑
2Na3AlF6+3CO2↑+6H2O O2--4e=O2↑
【解析】
由框图可知铝土矿加氢氧化钠后,Al2O3和SiO2会发生反应生成的滤液为NaAlO2和Na2SiO3,加入CaO沉淀为CaSiO3,滤液II的主要成分是NaAlO2,再通入气体CO2,生成沉淀Al(OH)3,加热即可得到Al2O3。
(1)因为铝土矿的主要成分是Al2O3和SiO2,反应1为加NaOH溶液,发生的反应为2NaOH+SiO2=Na2SiO3+H2O,2NaOH+Al2O3![]() 2NaAlO2+H2O。所以答案:2NaOH+Al2O3=2NaAlO2+H2O;
2NaAlO2+H2O。所以答案:2NaOH+Al2O3=2NaAlO2+H2O;
(2)滤液I的主要成分是NaAlO2和Na2SiO3,加入生石灰发生反应:CaO+H2O=Ca(OH)2和Ca(OH)2+Na2SiO=CaSiO3+2NaOH;滤液II的主要成分是NaAlO2,通入的气体A应是CO2,发生反应的方程式为2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3。
所以答案:CaSiO3;2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3;
(3)CaF2加入浓硫酸能发生反应,反应的方程式为CaF2+H2SO4(浓)=CaSO4+2HF,则D为HF。由D制备冰晶石的化学方程式为12HF+3Na2CO3+2Al(OH)3=2Na3AlF6+3CO2+9H2O。
所以答案为:12HF+3Na2CO3+2Al(OH)3=2Na3AlF6+3CO2+9H2O;
(4)电解熔融的Al2O3可生成铝和氧气,其反应的方程式为2Al2O3![]() 4A1+3O2↑,在阳极发生氧化反应,其电极反应方程式为:O2--4e=O2↑;答案为:O2--4e=O2↑。
4A1+3O2↑,在阳极发生氧化反应,其电极反应方程式为:O2--4e=O2↑;答案为:O2--4e=O2↑。

 阅读快车系列答案
阅读快车系列答案