题目内容
实验室配制浓度为0.2mol/L的A、B两种溶液各500ml,其中A为氢氧化钠溶液,B为硫酸溶液,提供的药品是NaOH固体,98%的浓硫酸(密度1.84g/cm3)和蒸馏水,请回答:应取NaOH______g,取浓硫酸______ml.
【答案】分析:根据配制溶液前后溶质的物质的量不变及c= 、m=n×M来计算.
、m=n×M来计算.
解答:解:A为氢氧化钠溶液,配制浓度为0.2mol/L的A溶液500ml,
则n(NaOH)=0.2mol/L×0.5L=0.1mol,
m(NaOH)=0.1mol×40g/mol=4g;
B为硫酸溶液,实验室配制浓度为0.2mol/L的B两种溶液500ml,
设取浓硫酸为x,
根据配制溶液前后溶质的物质的量不变,则
0.2mol/L×0.5L=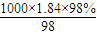 ×x,
×x,
解得x=5.4×10-3L=5.4mL,
故答案为:4;5.4.
点评:本题考查物质的量浓度的有关计算,学生明确配制溶液时溶质的量不变时解答的关键,并熟悉质量分数与浓度的换算公式来解答即可.
 、m=n×M来计算.
、m=n×M来计算.解答:解:A为氢氧化钠溶液,配制浓度为0.2mol/L的A溶液500ml,
则n(NaOH)=0.2mol/L×0.5L=0.1mol,
m(NaOH)=0.1mol×40g/mol=4g;
B为硫酸溶液,实验室配制浓度为0.2mol/L的B两种溶液500ml,
设取浓硫酸为x,
根据配制溶液前后溶质的物质的量不变,则
0.2mol/L×0.5L=
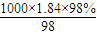 ×x,
×x,解得x=5.4×10-3L=5.4mL,
故答案为:4;5.4.
点评:本题考查物质的量浓度的有关计算,学生明确配制溶液时溶质的量不变时解答的关键,并熟悉质量分数与浓度的换算公式来解答即可.

练习册系列答案
相关题目
 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数