题目内容
【题目】已知A(g)+B(g)C(g)+D(s)反应的平衡常数与温度的关系如下:
温度℃ | 700 | 800 | 880 | 1000 | 1200 |
平衡常数 | 1.0 | 10.0 | 12.5 | 16.1 | 17.7 |
回答下列问题:
(1)该反应的平衡常数表达式K= , △H0(填“>、<、或=”);
(2)800℃时,向一个5L的密闭容器中充入0.4molA和0.7molB,若反应初始2mim内A的平均反应速率为0.01molL﹣1min﹣1 , 则2min时c(A)=molL﹣1 , C的物质的量为mol;若经过一段时间后,反应达到平衡时再向容器中充入0.4molA,则再次达到平衡后A的百分含量与第一次平衡相比(填“增大”、“减小”、或“不变”)
(3)下列选项中能作为判断反应达到平衡的依据有 a.压强不随时间改变
b.v(A):v(b)=1:1
c.单位时间内消耗A和B的物质的量相等
d.C的百分含量保持不变
(4)880℃ 时,反应 C(g)+D(s)A(g)+B(g)的平衡常数的值为 .
(5)某温度时,平衡浓度符合下式:c(A).c(B)=c(C),则该此时的温度为℃.
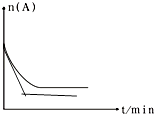
(6)图是1000℃时容器中A的物质的量的变化曲线,请在图中补画出该反应在1200℃时A的物质的量的变化曲线图 . 
【答案】
(1)![]() ;>
;>
(2)0.06;0.1;增大
(3)ad
(4)0.08
(5)700
(6)
【解析】解:(1)由A(g)+B(g)C(g)+D(s),纯固体不能代入K的表达式中,K= ![]() ,由表格数据可知,温度越高,K越大,则正反应为吸热反应,△H>0,所以答案是:
,由表格数据可知,温度越高,K越大,则正反应为吸热反应,△H>0,所以答案是: ![]() ;>;(2)800℃时,K=10.0,初始2mim内A的平均反应速率为0.01molL﹣1min﹣1 , 转化的A为0.02mol/L,则
;>;(2)800℃时,K=10.0,初始2mim内A的平均反应速率为0.01molL﹣1min﹣1 , 转化的A为0.02mol/L,则
A(g)+ | B(g) | C(g)+ D(s) | |
开始 | 0.08 | 0.14 | 0 |
转化 | 0.02 | 0.02 | 0.02 |
2min | 0.06 | 0.12 | 0.02 |
则2min时c(A)=0.06molL﹣1 , C的物质的量为0.02mol/L×5L=0.1mol;此时,Qc= ![]() =2.78<K,平衡正向移动,
=2.78<K,平衡正向移动,
A(g)+ | B(g) | C(g)+ D(s) | |
开始 | 0.08 | 0.14 | 0 |
转化 | X | x | X |
平衡 | 0.08-x | 0.14-x | X |
![]() =10,
=10,
解得x=0.04mol/L,
平衡后A的百分含量为 ![]() ×100%=22.2%,
×100%=22.2%,
反应达到平衡时再向容器中充入0.4molA,平衡正向移动,则
A(g)+ | B(g) | C(g)+ D(s) | |
开始 | 0.04+0.08 | 0.1 | 0.04 |
转化 | X | X | X |
平衡 | 0.12-x | 0.1-x | 0.04+x |
![]() =10.0,
=10.0,
解得x=0.027mol/L,
平衡时A的含量为 ![]() ×100%=39.9%,
×100%=39.9%,
则再次达到平衡后A的百分含量与第一次平衡相比增大,
所以答案是:0.06;0.1;增大;(3)a.该反应为气体体积不等的反应,压强不随时间改变,达到平衡状态,故选; b.v(A):v(b)=1:1始终存在,不能判断达到平衡状态,故不选;c.单位时间内消耗A和B的物质的量相等,只体现正反应速率关系,不能判定平衡,故不选; d.C的百分含量保持不变,可知浓度不变,为平衡状态,故选;所以答案是:ad;(4)880℃时,A(g)+B(g)C(g)+D(s)反应的平衡常数K=12.5,互为相反的两个反应的K互为倒数关系,则880℃时,反应 C(g)+D(s)A(g)+B(g)的平衡常数的值为 ![]() =0.08,所以答案是:0.08;(5)某温度时,平衡浓度符合下式:c(A).c(B)=c(C),可知K=
=0.08,所以答案是:0.08;(5)某温度时,平衡浓度符合下式:c(A).c(B)=c(C),可知K= ![]() =1,则该此时的温度为700℃,所以答案是:700;(6)升高温度,反应速率加快,平衡正向移动,平衡时A的物质的量比原平衡的小,在1200℃时A的物质的量的变化曲线图为
=1,则该此时的温度为700℃,所以答案是:700;(6)升高温度,反应速率加快,平衡正向移动,平衡时A的物质的量比原平衡的小,在1200℃时A的物质的量的变化曲线图为  ,所以答案是:
,所以答案是:  .
.
【考点精析】利用化学平衡的计算对题目进行判断即可得到答案,需要熟知反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.




