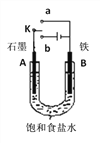
题目内容
【题目】过氧化钙(CaO2)是一种安全无毒的物质,带有结晶水,通常还含有CaO。经审查,面粉中添加过氧化钙已无技术上的必要性,因此,卫生部严令禁止在面粉生产中添加等添加剂。但过氧化钙在工农业生产中广泛用作杀菌剂、防腐剂、解酸剂、油类漂白剂等。
(1)称取5.42 g过氧化钙样品,灼热时发生如下反应:
2[CaO2·xH2O] → 2CaO + O2↑+ 2xH2O,得到O2在标准状况下体积为672 mL,该样品中CaO2的物质的量为________。
(2)另取同一样品5.42 g,溶于适量稀盐酸中,然后加入足量的Na2CO3溶液,将溶液中Ca2+全部转化为CaCO3沉淀,得到干燥的CaCO3 7.0 g。
①样品中CaO的质量为________。
②样品中CaO2·xH2O中的x值为________。
【答案】 0.06 mol 0.56 g 1/2
【解析】(1)n(O2)=0.672L÷22.4L/mol=0.03mol,则根据方程式可知
2(CaO2XH2O)![]() 2CaO+O2↑+2XH2O
2CaO+O2↑+2XH2O
2mol 1mol
n(CaO2XH2O) 0.03mol
解得n(CaO2XH2O)=0.06mol
则n(CaO2)=n(CaO2XH2O)=0.06mol
(2)n(CaCO3)=7g÷100g/mol=0.07mol
①根据Ca元素守恒,可知:n(CaO)=0.07mol-0.06mol=0.01mol
所以m(CaO)=0.01mol×56g/mol=0.56g
②样品中水的质量为:
m(H2O)=5.42g-m(CaO2)-m(CaO)=5.42g-0.06mol×72g/mol-0.56g=0.54g
所以n(H2O)=0.54g÷18g/mol=0.03mol
则X=![]() =0.03mol÷0.06mol =0.5
=0.03mol÷0.06mol =0.5

【题目】在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。下表是1L“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
成分 | 质量(g) | 摩尔质量(g/mol) |
蔗糖 | 50.00 | 342 |
硫酸钾 | 0.87 | 174 |
阿司匹林 | 0.35 | 180 |
高锰酸钾 | 0.158 | 158 |
硝酸银 | 0.04 | 170 |
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是__________。
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)在溶液配制过程中,下列操作正确且对配制结果没有影响的是__________。
A.将药品放入容量瓶中加蒸馏水溶解
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(3)配制上述1L“鲜花保鲜剂”所需的玻璃仪器有:烧杯、玻璃棒、__________、__________。(在横线上填写所缺仪器的名称)
(4)“鲜花保鲜剂”中K+(蔗糖、阿司匹林中不含K+) 的物质的量浓度为__________mol·L-1。
【题目】I.CH4与CO2的混合气体的密度是相同条件下H2密度的14倍,则混合气体中CH4与CO2的分子个数比为_________;
对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的。
II.根据物质的组成和性质将下列无机化合物进行了分类。
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①H2SO4 ②_______ | ③NaOH ④__________ | ⑤Na2SO4 ⑥K2CO3 | ⑦SO2 ⑧Na2O | ⑨HCl ⑩________ |
(1)请仔细观察表格中的物质类别,从K、H、O、C、N五种元素中任选两种或三种组成合适的弱电解质,将化学式分别填在表中②、④、⑩后面的横线上。
(2)⑦和⑧可发生非氧化还原反应,生成一种盐。该反应的化学方程式为_______;
(3)将⑧的固体加入①的稀溶液中,反应的离子方程式为_______________;
(4)下列关于氧化物的叙述,正确的是_________。
A.金属氧化物一定属于碱性氧化物
B.碱性氧化物一定属于金属氧化物
C.非金属氧化物一定属于酸性氧化物
D.酸性氧化物一定属于非金属氧化物
(5)下列关于酸、碱、盐元素组成的说法中,正确的是_________。
A.酸、碱一定含有氢,盐一定不含氢
B.酸、碱、盐可能都不含金属元素
C.碱、盐可能含氧,酸一定含氧
D.盐、碱一定含有金属元素,酸一定不含金属元素