题目内容
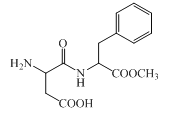
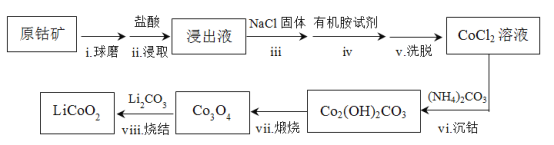
【题目】LiCoO2是锂离子电池最早使用的电极材料,利用原钴矿(含Cr2O3、NiS等杂质)制备LiCoO2的工艺流程如下:
资料:i. 在含一定量Cl的溶液中,钴离子以CoCl42-形式存在:Co2++4Cl![]() CoCl42
CoCl42
ii. CoCl42溶于有机胺试剂,有机胺不溶于水。
iii. 盐酸溶液中,有机胺试剂对金属离子的溶解率随盐酸浓度变化如图所示:
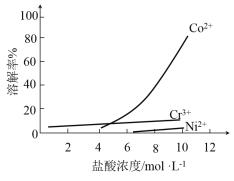
(1)步骤ii选用盐酸的浓度应为__________。
a. 4 mol/L b. 6 mol/L c. 10 mol/L
(2)从平衡移动角度解释步骤ⅲ中加入NaCl固体的目的_____________。
(3)步骤iv的操作是_______。
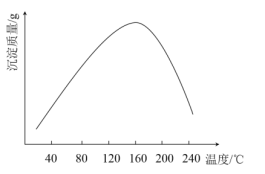
(4)步骤vi用(NH4)2CO3作沉淀剂,在一定条件下得到碱式碳酸钴(Co2(OH)2CO3)。实验测得在一段时间内加入等量(NH4)2CO3所得沉淀质量随反应温度的变化如图所示,分析曲线下降的原因____________。
(5)步骤viii中Co3O4 和Li2CO3 混合后,鼓入空气,经高温烧结得到LiCoO2。该反应的化学方程式是_____________。
(6)锂离子电池的工作原理如图,充、放电过程中,Li+在LiCoO2电极和碳电极之间传递。电池的总反应为:LixC + Li1-xCoO2 ![]() C+LiCoO2
C+LiCoO2
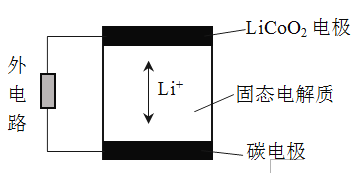
①放电时,电池的负极是______。
②充电时,电池的阴极反应式是______。
【答案】c 加入NaCl固体,溶液中Cl浓度增大,平衡Co2++4Cl![]() CoCl42右移,CoCl42浓度增大,提高其在有机胺试剂中的浓度。 分液 温度过高,碳酸铵分解(或NH4+和CO32-水解程度增大),碳酸铵浓度降低,沉淀质量减少。 4Co3O4 + 6Li2CO3 + O2
CoCl42右移,CoCl42浓度增大,提高其在有机胺试剂中的浓度。 分液 温度过高,碳酸铵分解(或NH4+和CO32-水解程度增大),碳酸铵浓度降低,沉淀质量减少。 4Co3O4 + 6Li2CO3 + O2![]() 12LiCoO2 + 6CO2 LiCoO2 Li1-xCoO2+xLi++xe== LiCoO2
12LiCoO2 + 6CO2 LiCoO2 Li1-xCoO2+xLi++xe== LiCoO2
【解析】
分析流程图,结合提供的资料,该工艺流程过程为:处理后的原钴矿用盐酸浸取后钴溶解,溶液中含Cr3+、Ni2+等杂质;在氯化钠共同作用下,Co2+大量转化成CoCl4-,用有机胺试剂萃取,经分液后与水中杂质分离;在洗脱过程中又重新转化成CoCl2溶液,再与加入的碳酸铵发生反应生成碱式碳酸钴,煅烧后又生成四氧化三钴,最后与碳酸钠烧结成产品LiCoO2。在此分析基础上结合图表及相关知识可解各小题。
(1)分析所给图可知:盐酸浓度为4mol/L、6moI/L时,杂质的含量虽然低,但Co2+的溶解率也低;盐酸浓度为10mol/L时,Co2+的溶液率很高,而杂质溶解率低,故应选择10mol/L,答案为:C
(2)步骤iii的目的是尽可能把二价钴转化成CoCl4-,根据反应Co2++4Cl![]() CoCl42可知,氯化钠的溶解增大了Cl-浓度,使平衡正向移动,提高了Co2+的转化率,故答案为:加入NaCl固体,溶液中Cl浓度增大,平衡Co2++4Cl
CoCl42可知,氯化钠的溶解增大了Cl-浓度,使平衡正向移动,提高了Co2+的转化率,故答案为:加入NaCl固体,溶液中Cl浓度增大,平衡Co2++4Cl![]() CoCl42右移,CoCl42浓度增大,提高其在有机胺试剂中的浓度
CoCl42右移,CoCl42浓度增大,提高其在有机胺试剂中的浓度
(3)有机胺试剂与水不相溶,故可采用分液的方法分离,故答案为:分液
(4)由图可知,在一段时间内加入等量碳酸铵所得沉淀质量随温度的升高,先增大后减小,因考虑温度对,反应的影响:一方面,温度高有利于CO32-和Co2+的水解,从而有利于生成碱式碳酸钴;另一方面,温度升高,使碳酸铵的双水解程度增大,致使碳酸铵分解,浓度降低,溶液碱性下降,不利与Co2+的水解成Co(OH)2CO3,故答案为:温度过高,碳酸铵分解(或NH4+和CO32-水解程度增大),碳酸铵浓度降低,沉淀质量减少
(5)不难写出步骤viii的反应为:4Co3O4 + 6Li2CO3 + O2![]() 12LiCoO2 + 6CO2,故答案为:4Co3O4 + 6Li2CO3 + O2
12LiCoO2 + 6CO2,故答案为:4Co3O4 + 6Li2CO3 + O2![]() 12LiCoO2 + 6CO2
12LiCoO2 + 6CO2
(6)根据电池反应LixC + Li1-xCoO2 ![]() C+LiCoO2:
C+LiCoO2:
①.放电时负极发生氧化反应,所含元素化合价升高,物质变化为LiCoO2→Li1-xCoO2,电极是LiCoO2,答案为:LiCoO2
②.充电时阴极发生还原反应,物质的变化为:Li1-xCoO2 →LiCoO2,电极反应式:Li1-xCoO2+xLi++xe== LiCoO2,故答案为:Li1-xCoO2+xLi++xe== LiCoO2

 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案【题目】盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的化学试剂。欲测定某NaOH溶液的物质的量浓度,可用0.1000 mol·L-1 HCl标准溶液进行中和滴定(用酚酞作指示剂)。请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为_____。
(2)碱式滴定管用蒸馏水洗净后,接下来应该进行的操作是_________。
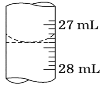
(3)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50 mL,滴定后液面如图,则此时消耗标准溶液的体积为_____。
乙学生做了三组平行实验,数据记录如下:
实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.11 | 25.10 |
2 | 25.00 | 1.56 | 33.30 |
3 | 25.00 | 0.21 | 25.22 |
(4)选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为______(保留四位有效数字)。
(5)下列哪些操作会使测定结果偏高_____ (填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
(6)滴定达到终点的标志是________。