题目内容
将4.68gNaNO3、NaCl、Na2CO3的混合物溶于水,向其中滴加30mL1.00mol/LAgNO3溶液后,不再有沉淀生成。过滤后,使沉淀与足量稀硝酸作用,产生112mL(标准状况)气体。计算原混合物中NaCl的质量分数。
原混合物中NaCl的质量分数=1.17g/4.68g×100%=25%
反应中加入的AgNO3可与NaCl和Na2CO3反应,根据生成的二氧化碳的体积可推算出与Na2CO3反应的AgNO3的量,则可求出与NaCl反应的AgNO3的量,进而计算出原混合物中NaCl的质量及质量分数。
设与Na2CO3反应的AgNO3的物质的量为x,
Na2CO3 ~ 2 AgNO3 ~ CO2
2mol 22.4L
x 0.112L
x=0.01mol
则与NaCl反应的AgNO3的物质的量=0.03L×1.00mol/L-0.01mol=0.02mol
设原混合物中NaCl的质量为y。
NaCl ~ AgNO3
58.5g 1mol
y 0.02mol
y=1.17g
设与Na2CO3反应的AgNO3的物质的量为x,
Na2CO3 ~ 2 AgNO3 ~ CO2
2mol 22.4L
x 0.112L
x=0.01mol
则与NaCl反应的AgNO3的物质的量=0.03L×1.00mol/L-0.01mol=0.02mol
设原混合物中NaCl的质量为y。
NaCl ~ AgNO3
58.5g 1mol
y 0.02mol
y=1.17g

练习册系列答案
相关题目
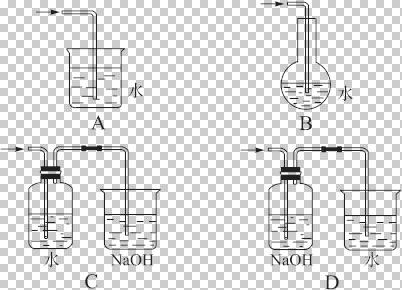
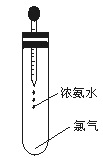
 NH3↑+HCl↑,推测:NH4I
NH3↑+HCl↑,推测:NH4I HBr+HIO
HBr+HIO