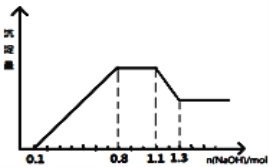
题目内容
【题目】某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。(忽略氧气对反应的影响)
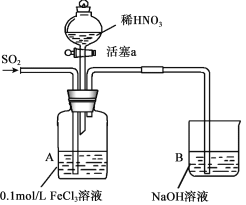
实验记录如下:
实验序号 | 实验操作 | 实验现象 |
I | 向A装置中通入一段时间的SO2气体。 | A中黄色溶液迅速变成深红棕色,最终变为浅绿色。 |
II | 取出少量A装置中的溶液,先加入KSCN溶液,再加入BaCl2溶液。 | 加入KSCN溶液后溶液不变色,再加入BaCl2溶液产生白色沉淀。 |
III | 打开活塞a,将过量稀HNO3加入装置A中,关闭活塞a | A中浅绿色溶液最终变为黄色。 |
IV | 取出少量A装置中的溶液,加入KSCN溶液;向A装置中通入空气。 | 溶液变为红色;液面上方有少量红棕色气体生成。 |
请回答下列问题:
(1)配制FeCl3溶液时,常常加入盐酸,目的是(用化学方程式和简单文字叙述): 。
(2)资料表明,Fe3+能与SO2结合形成深红棕色物质Fe(SO2)63+,反应方程式为: Fe3+ + 6SO2 ![]() Fe(SO2)63+。请用化学平衡移动原理解释实验I中溶液颜色变化的原因 。
Fe(SO2)63+。请用化学平衡移动原理解释实验I中溶液颜色变化的原因 。
(3)实验II中发生反应的离子方程式是 。
(4)实验III中,浅绿色溶液变为黄色的原因是(用离子方程式表示) 。
(5)实验IV中液面上方有少量红棕色气体生成,发生反应的方程式是 。
(6)综合上述实验得出的结论是:在酸性条件下,NO3-、SO42-、Fe3+三种微粒的氧化性由强到弱的顺序是: 。
【答案】(1)Fe3++3H2O![]() Fe(OH)3+3H+,加入盐酸,增大c(H+),平衡左移,抑制Fe3+水解;
Fe(OH)3+3H+,加入盐酸,增大c(H+),平衡左移,抑制Fe3+水解;
(2)Fe3+和SO2生成红棕色的Fe(SO2)63+反应速率较快:Fe3++6SO2![]() Fe(SO2)63+;而反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+反应缓慢,但是反应限度较大,使溶液中c(Fe3+)降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液;(3)Ba2++SO42-=BaSO4↓;
Fe(SO2)63+;而反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+反应缓慢,但是反应限度较大,使溶液中c(Fe3+)降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液;(3)Ba2++SO42-=BaSO4↓;
(4)3Fe2++4H++NO3-=3Fe3++NO↑+2H2O;(5)2NO+O2=2NO2;
(6)氧化性强弱是:NO3->Fe3+>SO42-。
【解析】
试题分析:(1)FeCl3属于强酸弱碱盐,Fe3+要发生水解,其水解反应方程式:Fe3++3H2O![]() Fe(OH)3+3H+,加入盐酸,增大c(H+),平衡左移,抑制Fe3+水解;(2)通入SO2后溶液先变为深红棕色,发生Fe3++6SO2
Fe(OH)3+3H+,加入盐酸,增大c(H+),平衡左移,抑制Fe3+水解;(2)通入SO2后溶液先变为深红棕色,发生Fe3++6SO2![]() Fe(SO2)63+;然后利用Fe3+的强氧化性和SO2的强还原性,两者发生2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,使溶液中c(Fe3+)降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液;(3)加入KSCN溶液,溶液不变色,说明不含Fe3+,加入BaCl2溶液产生白色沉淀,说明溶液中含有SO42-,因此发生的反应是Ba2++SO42-=BaSO4↓;(4)硝酸具有强氧化性,把Fe2+氧化成Fe3+,溶液由浅绿色变为黄色,发生的反应是:3Fe2+ +4H++ NO3- = 3Fe3++NO↑+2H2O;(5)红棕色气体为NO2,因此发生的反应是2NO+O2=2NO2;(6)根据氧化还原反应中强弱规律,因此NO3->Fe3+>SO42-。
Fe(SO2)63+;然后利用Fe3+的强氧化性和SO2的强还原性,两者发生2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,使溶液中c(Fe3+)降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液;(3)加入KSCN溶液,溶液不变色,说明不含Fe3+,加入BaCl2溶液产生白色沉淀,说明溶液中含有SO42-,因此发生的反应是Ba2++SO42-=BaSO4↓;(4)硝酸具有强氧化性,把Fe2+氧化成Fe3+,溶液由浅绿色变为黄色,发生的反应是:3Fe2+ +4H++ NO3- = 3Fe3++NO↑+2H2O;(5)红棕色气体为NO2,因此发生的反应是2NO+O2=2NO2;(6)根据氧化还原反应中强弱规律,因此NO3->Fe3+>SO42-。

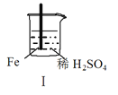
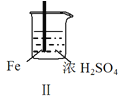
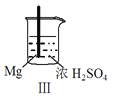
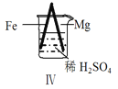
【题目】 Fe和Mg与H2SO4反应的实验如下:
实验 |
|
|
|
|
现象 | Fe表面产生大量无色气泡 | Fe表面产生气泡后迅速停止 | Mg表面迅速产生大量气泡 | Fe表面有大量气泡,Mg表面有少量气泡 |
关于上述实验说法不合理的是( )
A.I中产生气体的原因是:Fe + 2H+=Fe2++ H2↑
B.取出Ⅱ中的铁棒放入CuSO4溶液立即析出亮红色固体
C.Ⅲ中现象说明Mg在浓H2SO4中没被钝化
D.Ⅳ中现象说明Mg的金属性比Fe强