题目内容
把Ba(OH)2溶液滴入明矾[KAl(SO4)2=K++Al3++2SO42-]溶液中,使SO42-全部转化成BaSO4沉淀,此时铝元素的主要存在形式是( )
A.Al3+B. Al(OH)3 C.AlO2- D.Al3+和Al(OH)3.
A.Al3+B. Al(OH)3 C.AlO2- D.Al3+和Al(OH)3.
分析:明矾的化学式为KAl(SO4)2?12H2O,设明矾为1mol,则溶液中含有1molAl3+、2molSO42-,根据反应SO42-+Ba2+=BaSO4↓、Al3++4OH-=AlO2-+2H2O判断.
解答:解:明矾的化学式为KAl(SO4)2?12H2O,设明矾为1mol,则溶液中含有1molAl3+、2molSO42-,由反应SO42-+Ba2+=BaSO4↓可知,使SO42-全部转化成BaSO4沉淀,需要2molBa(OH)2,则加入4molOH-,则发生Al3++4OH-=AlO2-+2H2O,所以最后溶液中存在AlO2-;
故选C.
故选C.
点评:本题考查离子方程式的书写,题目难度中等,本题中注意判断使SO42-全部转化成BaSO4沉淀需要Ba(OH)2的物质的量,根据Al3+和OH-物质的量的关系判断反应产物.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
把Ba(OH)2溶液滴入KAl(SO4)2溶液中,使Al3+刚好全部转化成Al(OH)3沉淀时,溶液中离子浓度最大的是( )
| A、Ba2+ | B、K+ | C、SO42- | D、OH- |
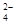 全部转化成BaSO4沉淀,此时铝元素的存在形式是
全部转化成BaSO4沉淀,此时铝元素的存在形式是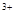 B.Al(OH)3 C.AlO
B.Al(OH)3 C.AlO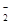 D.Al
D.Al