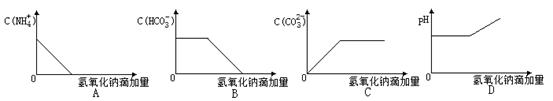
题目内容
下列表示对应化学反应的离子方程式正确的是
| A.向H2O中投入少量Na218O2固体:2H2O+2Na218O2=4Na++418OH-+O2↑ |
| B.Fe3O4与稀硝酸反应:Fe3O4+8H+=2Fe3++Fe2++4H2O |
| C.向含有0.4 mol FeBr2的溶液中通入0.5 mol Cl2充分反应:4Fe2++8Br-+5Cl2=4Fe3++10Cl-+4Br2 |
| D.Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-=5SO42-+2Mn2++3H2O |
D
解析试题分析:A、过氧化钠与水的反应中既是氧化剂,也是还原剂,所以向H2O中投入少量Na218O2固体的离子方程式为2H2O+2Na218O2=4Na++218OH-+2OH-+18O2↑,A不正确;B、硝酸是氧化性酸,与四氧化三铁发生氧化还原反应,反应的离子方程式为3Fe3O4+NO3-+28H+=9Fe3++NO↑+14H2O,B不正确;C、亚铁离子的还原性强于溴离子的,冷却首先氧化亚铁离子,所以向含有0.4 mol FeBr2的溶液中通入0.5 mol Cl2充分反应的离子方程式为4Fe2++6Br-+5Cl2=4Fe3++10Cl-+3Br2,C不正确;D、酸性高锰酸钾溶液能氧化亚硫酸钠,所以Na2SO3溶液使酸性KMnO4溶液褪色的离子方程式为5SO32-+6H++2MnO4-=5SO42-+2Mn2++3H2O,D正确,答案选D。
考点:可行离子方程式的正误判断

 阅读快车系列答案
阅读快车系列答案下列解释过程或事实的方程式不正确的是
| A.熔融烧碱时,不能使用普通石英坩埚:SiO2+2NaOH=Na2SiO3+H2O |
| B.甲醇燃料电池(KOH作电解质溶液)的负极反应式:CH3OH-6e+H2O=CO2+6H+ |
| C.红热的铁丝与水接触,表面形成黑色保护层: 3Fe + 4H2O=Fe3O4 + 4H2 |
| D.“84消毒液”(有效成分NaClO)和“洁厕灵”(主要成分盐酸)混合使用放出氯气:ClO-+Cl-+2H+= Cl2↑+H2O |
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100 mL溶液进行如下实验:
(1)第一份:加入AgNO3溶液有沉淀产生;
(2)第二份:加足量NaOH溶液加热后,收集到气体0.04 mol;
(3)第三份:加足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。根据上述实验,以下推测正确的是
| A.K+一定存在 |
| B.100 mL溶液中含0.01 mol CO32- |
| C.Cl-一定存在 |
| D.Ba2+一定不存在,Mg2+可能存在 |
某同学为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得到的正确结论是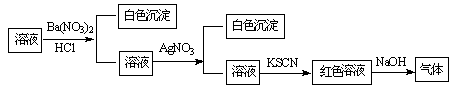
| A.原溶液中一定含有SO42-离子 | B.原溶液中一定含有NH4+离子 |
| C.原溶液中一定含有Cl-离子 | D.原溶液中一定含有Fe3+离子 |
下列离子方程式中,正确的是( )
| A.已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量二氧化碳: ClO-+CO2+ H2O =HClO+HCO3- |
| B.硅酸钠溶液与醋酸溶液混合: SiO32-+ 2H+ = H2SiO3↓ |
| C.从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH- |
| D.FeCl2溶液中滴加NaClO溶液生成红褐色沉淀: |
下列各组中的离子,能在溶液中大量共存的是
| A.K+、Cu2+、NO3-、SO42- | B.Na+、Ba2+、CO32-、NO3- |
| C.Na+、H+、Cl-、CO32- | D.Mg2+、H+、C1-、OH- |
下列离子组一定能大量共存的是 ( )
| A.能使甲基橙变红的溶液中:Na+、NH4+、I-、NO3- |
| B.含有0.1 mol·L-1Ba2+ 的溶液中:K+、Mg2+、CO32-、SO42- |
| C.由水电离出来的c(H+) = 1×10-13 mol·L-1的溶液中:K+、CH3COO-、Cl-、NO3- |
| D.常温下,KW/ c(OH-)="0.1" mol·L-1的溶液:Na+、SO42-、NH4+、NO3- |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.0.1 mol·L-1 KNO3溶液:Mg2+、Fe2+、Cl-、SO42- |
| B.无色透明的溶液:Cu2+、NH4+、NO3-、CO32- |
| C.使pH试纸变红的溶液:K+、Ca2+、Cl-、ClO- |
| D.水电离出的c(H+)=10-12 mol·L-1的溶液:Na+、NH4+、SO42-、NO3- |