题目内容
一定量CO2通入某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(CO2)的关系如图所示.下列有关叙述正确的是( )
| A.通入的CO2气体为22.4 L |
| B.A溶液中既含Na2CO3,又含NaHCO3 |
| C.A溶液中n(NaOH)=2n(Na2CO3) |
| D.A溶液中一定只有Na2CO3 |
C
解析试题分析:根据碳酸钠与盐酸的反应情况:①Na2CO3+HCl=NaHCO3+NaCl;②NaHCO3+HCl=NaCl+CO2↑+H2O。开始滴入3 mol HCl无气体生成,后滴入1 mol盐酸,生成1 mol CO2,而后再滴加盐酸无气体生成,说明A溶液为氢氧化钠与碳酸钠的混合物,根据上述化学反应机理,可以推断A溶液中碳酸钠为1 mol,氢氧化钠为2 mol,故B项D项错误,C项正确,A项没有标明为标准状况,错误。
考点:本题考查物质的化学性质和计算。

练习册系列答案
相关题目
在t℃时,将a gNH3完全溶于水,得到VmL溶液,假设该溶液的密度为ρg/cm3,质量分数为w,其中含NH4+的物质的量为b mol。下列叙述中正确的是( )
| A.溶质的质量分数w=(1000a/17V)100% |
| B.溶质的物质的量浓度c=1000a/17V (mol/L) |
| C.溶液中c(OH-)=b/V (mol/L) |
| D.上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5w |
用NA表示阿伏加德罗常数,下列关于0.2 mol·L-1K2SO4溶液的正确说法是 ( )
| A.1 L溶液中K+浓度是0.4 mol·L-1 |
| B.溶液中含有0.4NA个K+ |
| C.1 L溶液中所含K+、SO42-总数为0.3NA |
| D.2 L溶液中SO42-浓度是0.4 mol·L-1 |
设阿伏加德罗常数为NA,下列说法正确的是( )
| A.4.4 g乙醛分子中含有的共用电子对数为0.6NA |
| B.标准状况下,11.2 L二氯甲烷所含分子数为0.5 NA |
| C.18.8 g苯酚中含有碳碳双键的个数为0.6 NA |
| D.现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA |
有一种黄棕色气体X,其体积为20毫升,完全分解后生成10毫升的氯气和20毫升氧气(同温同压下测定),判断X为三原子分子依据的定律是( )
①质量守恒定律 ②能量守恒定律 ③能量最低原理 ④阿伏加德罗定律
| A.①② | B.①④ | C.②③ | D.②④ |
下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A.1 mol甲基含7 NA个电子 |
| B.1 mol聚乙烯含有的原子数目为6NA |
| C.标况下1 L己烷完全燃烧后恢复至原状态,生成气态物质分子数为6NA /22.4 |
| D.2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA |
下列说法不正确的是( )
| A.5.85gNaCl晶体溶于100g水,所得溶液物质的量浓度不等于1mol/L |
| B.20g浓度为c mol·L-1的氨水中加入一定量的水稀释成0.5cmol·L-1,则加入水的体积小于20ml |
| C.某氯化镁溶液的密度为1.18 g·cm-3,其中镁离子的质量分数为5.1%,300 mL该溶液中Cl-的物质的量约等于1.50 mol |
D.V L Fe2(SO4)3溶液中含Fe3+m g,则溶液中SO42-的物质的量浓度为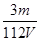 mol·L-1 mol·L-1 |
下列溶液中C(Cl-)与50mL 2mol·L-1 MgCl2溶液中C(Cl-)相等的是
| A.150 mL 2 mol·L-1的NaCl溶液 | B.75mL 1 mol·L-1的CaCl2溶液 |
| C.200mL 4mol·L-1的KCl溶液 | D.50 mL 1 mol ·L-1的AlCl3溶液 |