��Ŀ����
���������ھ�������������ˮ��������������ҵ�������������.
��1���������������������ҿ������������е��ʷ�Ӧ����:6Ag(s)+O3(g)=3Ag2O(s)? ��H=-235.8kJ/mol.��֪2Ag2O(s)=4Ag(s)+O2(g)? ��H=+62.2kJ/mol,�����·�Ӧ: 2O3(g)=3O2(g)����H=?????????????????????? .
��2����ѧ��P.Tatapudi��������ʹ�������������µ��ˮ�ķ����Ƶó�����������������Χ��ˮ�в���,�缫��ӦʽΪ3H2O-6e-=O3��+6H+,���������ܽ���ˮ�е��������ɹ�������,��缫��ӦʽΪ???????????????????? ��
��3��O3�ڼ��������¿ɽ�Na2SO4������Na2S2O8��д���÷�Ӧ�Ļ�ѧ����ʽΪ��????????????????????????
 ???????????
??????????? 
��4�����õ�Na2S2O8��Һ�ɽ����л���Ⱦ��4-CP��ԭ����Na2S2O8��Һ��һ�������¿ɲ���ǿ���������ɻ���SO4-������ͨ���ⶨ4-CP�����ʿ��ж�Na2S2O8��Һ����SO4-��������ij�о�С�����ʵ��̽������Һ����ԡ�Fe2+��Ũ�ȶԲ���SO4-����Ӱ�졣
����Һ����Ե�Ӱ�죺����������ͬ����4-CP���뵽��ͬpH��Na2S2O8��Һ�У������ͼa��ʾ���ɴ˿�֪����Һ������ǿ��???????????????? ���� ������������������������Na2S2O8����SO4-����
��Fe2+Ũ�ȵ�Ӱ�죺��ͬ�����£�����ͬŨ�ȵ�FeSO4��Һ�ֱ����c(4-CP)=1.56��10-4 mol��L��1��c(Na2S2O8)=3.12��10-3 mol��L��1�Ļ����Һ�С���Ӧ240 min����ʵ������ͼb��ʾ����֪ S2O82- + Fe2+= SO4-��+ SO42- + Fe3+������ͼʾ��֪����˵����ȷ���ǣ�_________________������ţ�
A.��Ӧ��ʼһ��ʱ���ڣ� 4-CP��������Fe2+Ũ�ȵ������������ԭ����Fe2+��ʹNa2S2O8���������SO4-����
B.Fe2+��4-CP���ⷴӦ�Ĵ���
C.��c(Fe2+)����ʱ��4-CP�����ʷ����½���ԭ�������Fe2+����SO4����������Ӧ�����IJ���SO4������
D.4-CP�����ʷ����½���ԭ����������ɵ�Fe3+ˮ��ʹ��Һ��������ǿ�������ڽ��ⷴӦ�Ľ��С�
����c(Fe2+)��3.2 ��10-3 mol��L��1ʱ��4-CP�����ƽ����Ӧ���ʵļ������ʽΪ??????????????? ��
��1��-285.0KJ.mol-1 ��3�֣�
��2��3O2 + 6H+ +6e- = 3H2O2 ����O2 +2H+ +2e- = H2O2�� ��3����
��3��2Na2SO4 + O3 + H2O = Na2S2O8 + 2NaOH + O2? ��3�֣�
��4�� ��������?? ��2�֣�
��AC��2�֣�
��
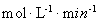 ? ��3�֣�
? ��3�֣�
��������
�������:��1�����ݸ�˹���ɣ�����ʽ����3����-1�������ã�������H=3��(+62.2kJ/mol) -2��(-235.8kJ/mol)= -285.0KJ.mol-1 ��
��2�����ڵ��ˮ���Ƴ���ʵ���ǵ���ܽ���������ˮ��Һ3O2 + 3H2O = O3��+3H2O2 ����Ȼ���������������㲻�μӷ�Ӧ�����Ե�����������������������ӦΪH2Oʧ���ӱ�ɳ�������������OH-�����������Ļ�ԭ��ӦΪO2�õ��ӱ��H2O2�����������缫��ӦʽΪ��O2 +2H+ +2e- = H2O2 ����Ҫ��������ʧ����ͳһ��Ҳ��д��3O2 + 6H+ +6e- = 3H2O2 ��
��3��O3�ڼ��������½�Na2SO4������Na2S2O8�ķ�Ӧ��һ��������ԭ��Ӧ��Ҫע�����O3�����ʺ�O2����������н�ǿ�������������Ҳ��ȶ������ױ��ΪO2�������ڸ÷�Ӧ����O3��Oԭ�Ӳ���ȫ���������������ֻ��ϼ۲�������Na2SO4 ��S��+6����+7���������ҳ���Ӧ������������ԭ������������ͻ�ԭ���������ȱ����ƽ��д��ѧ����ʽ����2Na2SO4 + O3 + H2O = Na2S2O8 + 2NaOH + O2 ��
��4����ͼa�����Կ��Կ��������ź�����pH������4-CP��������С�����������õ��Ǿ���ǿ�����Ե����ɻ���SO4-���������Խ����ʽ���˵��ǿ�������ɻ����٣�����������ǿ��������Na2S2O8����SO4-����
������ͼb���Կ�������ʼ��һ��ʱ�������ź�����Fe2+Ũ������4-CP����������������˵�������ʱ���ڣ�Fe2+��ʹNa2S2O8���������SO4-����A��ȷ��ǿ���������ɻ���ͨ��S2O82- + Fe2+= SO4-��+ SO42- + Fe3+��Ӧ�����ģ�����Fe2+ ���ǽ��ⷴӦ�Ĵ�����B������Ϊ���ɻ�SO4-����ǿ�����ԣ�������Fe2+ Ũ�ȹ�������������Ӧ��Fe2+ �ᱻ���ɵ����ɻ��������������ɻ����٣��������½���C��ȷ��D����ѡAC��
����c(Fe2+)��3.2 ��10-3 mol��L��1ʱ,��ͼ��b�п����ҵ���ʱ�Ľ�����52.4%������ʼŨ��Ϊc(4-CP)=1.56��10-4 mol��L��1 ��������240min�ڵķ�Ӧ����v=��C/��t=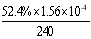
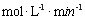 ��
��
���㣺���⿼����Ǹ�˹����Ӧ�á��绯ѧ�е缫��Ӧʽ����д��������ԭ��Ӧ����ʽ����ƽ����ѧ��Ӧ���ʵļ�������⡣

 ����˼ά�żӿ���ϵ�д�
����˼ά�żӿ���ϵ�д� �����Ծ�ϵ�д�
�����Ծ�ϵ�д���1���������������������ҿ������������е��ʷ�Ӧ���磺6Ag��s��+O3��g��=3Ag2O��s������H=-235.8kJ?mol-1����֪2Ag2O��s��=4Ag��s��+O2��g������H=+62.2kJ?mol-1�������·�Ӧ2O3��g��=3O2��g��Ϊ
��2��������ˮ���ֽ⣬������Ũ�ȼ���һ�������ʱ�����±���ʾ��
| pH t/min T/�� |
3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
��3����ѧ��P��Tatapudi��������ʹ�������������µ��ˮ�ķ����Ƶó�����������������Χ��ˮ�в������缫��Ӧ3H2O-6e-=O3��+6H+���������������������ɹ������⣬��缫��ӦʽΪ
��4��Ϊ�ⶨ�����г�����O3����������0�桢1.01��105Pa�Ŀ���V L����ͨ������KI��Һ��ʹ������ȫ��Ӧ��Ȼ��������Һ��a mL c mol?L-1��Na2S2O3��Һ���еζ�ǡ�õ����յ㣮
�ٸõζ������п�ѡ���ָʾ��Ϊ
��O3��KI��Һ��Ӧ�������ֵ��ʣ���Ӧ�Ļ�ѧ����ʽ
�ۿ����г������������Ϊ
����֪��2Na2S2O3+I2=Na2S4O6+2NaI��