题目内容
11.用NA表示阿伏伽德罗常数的值,下列叙述中正确的是( )| A. | 25℃时,28.6gNa2CO3•10H2O晶体中含的CO32-数目为0.1NA | |
| B. | 78.0g苯中σ键的数目为6NA | |
| C. | 标准状况下22.4LCl2通入足量的水中,反应转移的电子总数目为NA | |
| D. | 常温,pH=13的NaOH溶液中含有O.1NA个Na+ |
分析 A、求出Na2CO3•10H2O晶体的物质的量,然后根据1molNa2CO3•10H2O晶体中含1mol碳酸根来分析;
B、1mol苯中含12molσ键;
C、氯气和水的反应为可逆反应;
D、溶液体积不明确.
解答 解:A、28.6gNa2CO3•10H2O晶体的物质的量n=$\frac{28.6g}{286g/mol}$=0.1mol,而1molNa2CO3•10H2O晶体中含1mol碳酸根,故0.1molNa2CO3•10H2O晶体中含0.1mol碳酸根,即0.1NA个,故A正确;
B、78g苯的物质的量为1mol,而1mol苯中含12molσ键,即为12NA个,故B错误;
C、氯气和水的反应为可逆反应,不能进行彻底,故转移的电子数小于NA个,故C错误;
D、溶液体积不明确,故溶液中钠离子的个数无法计算,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
1.下列各化合物的命名中正确的是( )
| A. | CH2=CH-CH=CH21,3-二丁烯 | B. | 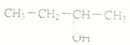 3-丁醇 | ||
| C. | 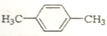 二甲苯 | D. | 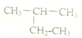 2-甲基丁烷 2-甲基丁烷 |
2.在下列自然资源的开发利用中,不涉及化学变化的是( )
| A. | 通过石油分馏获得汽油 | B. | 以海带为原料制取碘单质 | ||
| C. | 利用海水制取金属镁 | D. | 用CO还原褐铁矿制备铁 |
19.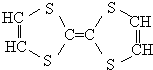 用于制造隐形飞机的物质具有吸收微波的功能,其主要成分的结构如图,关于该分子的说法正确的有( )
用于制造隐形飞机的物质具有吸收微波的功能,其主要成分的结构如图,关于该分子的说法正确的有( )
 用于制造隐形飞机的物质具有吸收微波的功能,其主要成分的结构如图,关于该分子的说法正确的有( )
用于制造隐形飞机的物质具有吸收微波的功能,其主要成分的结构如图,关于该分子的说法正确的有( )| A. | 分子中含有碳碳双键,属于烯烃 | |
| B. | 从碳骨架形状分析,应该属于环状烃 | |
| C. | 该分子属于高分子化合物 | |
| D. | 该分子中即有极性键,也有非极性键 |
16.下列不能形成配位键的是( )
| A. | Ag+ NH3 | B. | Cu2+ NH3 | C. | H+ H2O | D. | Ag+ CH4 |
20.下列说法中正确的是( )
| A. | 汽油、柴油和植物油都是碳氢化合物 | |
| B. | 利用核磁共振氢谱图可鉴别1-溴丙烷和2-溴丙烷 | |
| C. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 | |
| D. | 含5个碳原子的有机物,每个分子中最多可形成4个C-C单键 |
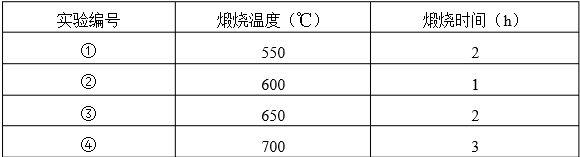
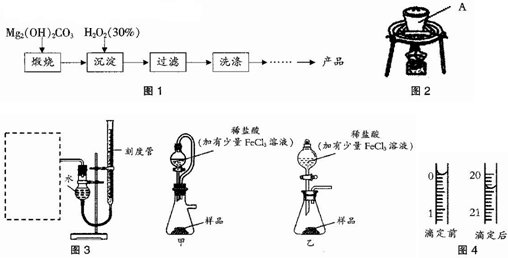
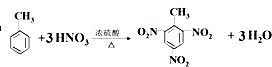
 .
.