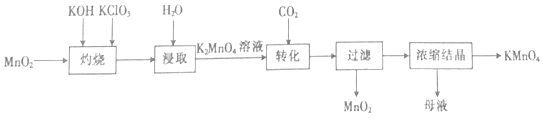
题目内容
【题目】某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+mY(g)3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%,在此平衡体系中加入1molZ(g),再将达到平衡后,X、Y、Z的体积分数不变.下列叙述不正确的是( )
A.m=2
B.两次平衡的平衡常数相同
C.X与Y的平衡转化率之比为1:1
D.第二次平衡时,Z的浓度为0.4molL﹣1
【答案】D
【解析】解:A.平衡时,X、Y、Z的体积分数分别为30%、60%、10%,在此平衡体系中加入1molZ(g),再将达到平衡后,X、Y、Z的体积分数不变,说明反应前后气体计量数之和不变,所以m=2,故A正确; B.平衡常数只与温度有关,温度不变,平衡常数不变,所以两次平衡的平衡常数相同,故B正确;
C.设第一次达到平衡状态时X参加反应的物质的量为amol,
X(g)+ | 2Y(g) | 3Z(g) | ||
开始(mol) | 1 | 2 | 0 | |
转化(mol) | a | 2a | 3a | |
平衡(mol) | (1﹣a) | (2﹣2a) | 3a |
相同条件下,气体的体积与物质的量成正比,所以其体积分数等于其物质的量分数,即(1﹣a):(2﹣2a):3a=30%:60%:10%,所以a=0.1,则参加反应的△n(X)=0.1mol、△n(Y)=0.2mol,
转化率= ![]() ,
,
X的转化率= ![]() =10%,Y的转化率=
=10%,Y的转化率= ![]() =10%,所以X和Y的转化率之比为1:1,故C正确;
=10%,所以X和Y的转化率之比为1:1,故C正确;
D.该反应的反应前后气体计量数之和不变,第一次反应是按照X、Y的计量数之比来投料,所以第二次平衡与第一次平衡是等效平衡,两次平衡后各物质的含量不变,投入Z后,设Z参加反应的物质的量为3bmol,
X(g)+ | 2Y(g) | 3Z(g) | ||
第一次平衡(mol): | 0.9 | 1.8 | 0.3 | |
加入1molZ: | 0.9 | 1.8 | 1.3 | |
转化: | b | 2b | 3b |
第二次平衡(mol):(0.9+b) (1.8+2b)(1.3﹣3b)
各物质含量不变,所以(0.9+b):(1.8+2b):(1.3﹣3b)=30%:60%:10%=3:6:1,
b=0.3,n(Z)=(1.3﹣0.9)mol=0.4mol,Z的物质的量浓度= ![]() =0.2mol/L,故D错误;
=0.2mol/L,故D错误;
故选D.
A.平衡时,X、Y、Z的体积分数分别为30%、60%、10%,在此平衡体系中加入1molZ(g),再将达到平衡后,X、Y、Z的体积分数不变,说明反应前后气体计量数之和不变;
B.平衡常数只与温度有关,温度不变,平衡常数不变;
C.设第一次达到平衡状态时X参加反应的物质的量为amol,根据转化率= ![]() 进行计算;
进行计算;
D.该反应的反应前后气体计量数之和不变,第一次反应是按照X、Y的计量数之比来投料,所以第二次平衡与第一次平衡是等效平衡,两次平衡后各物质的含量不变,据此解答.