题目内容
中学化学实验中常用到碳酸钠溶液,下列有关叙述错误的是
| A.在实验室中,能用碳酸钠溶液制备少量烧碱 |
| B.实验室制CO2气体时,用饱和碳酸钠溶液除去其中混有的HCl气体 |
| C.制取乙酸丁酯时,用于除去混有的丁醇和乙酸 |
| D.做银镜反应实验时,可用热的碳酸钠溶液洗涤掉反应前试管内壁上的油污 |
B
解析试题分析:A. Na2CO3+ Ca(OH)2=CaCO3↓+2NaOH.因此在实验室中,能用碳酸钠溶液制备少量烧碱。正确。B.实验室制CO2气体时,CO2气体中常含有少量的HCl气体,可以用饱和碳酸氢钠溶液来除去。反应的方程式为NaHCO3+HCl=NaCl+H2O+ CO2↑。若要饱和的碳酸钠溶液,则还会发生反应:Na2CO3++H2O+ CO2= 2NaHCO3.使CO2气体也损耗。故错误。C.碳酸钠能与乙酸发生反应产生乙酸钠、二氧化碳和水,又可以溶解丁醇,减少丁醇的气味,还可以降低乙酸丁酯的溶解度,便于分离。正确。D.做银镜反应实验时,试管必须洁净,特别是不能有油污,否则产生的Ag不能在试管壁上附着,而是产生疏松的银颗粒。碳酸钠溶液水解使溶液显碱性,可以与油污发生酯的水解反应而产生容易溶解于水的物质。升高温度促进盐的水解,使盐溶液的碱性增强,洗涤效果更好。因此正确。
考点:考查碳酸钠溶液在中学化学实验中的应用的知识。

练习册系列答案
相关题目
下列叙述正确的是
| A.在Na2O2与H2O反应中,Na2O2是氧化剂,H2O是还原剂 |
| B.Na2O与Na2O2中阴离子个数与阳离子个数之比均为1:2 |
| C.用氯化钙溶液鉴别 NaHCO3和Na2CO3溶液 |
| D.质量相等的Na2CO3和NaHCO3分别与足量盐酸反应,二者生成的CO2一样多 |
已知氧化性Fe3+>Cu2+。现将铜粉放入稀盐酸中,微热后无明显现象发生;当加入下列物质后,铜粉的质量减少。则加入的物质不可能是
| A.FeSO4 | B.Fe2(SO4)3 | C.KNO3 | D.HNO3 |
下列各组反应属于铝热反应的是
| A.Al2O3+NaOH | B.Al+Fe3O4 | C.Al+CuSO4 | D.Al+HCl |
科学家冶炼出了纯度高达99.9999%的铁,你估计它不会具有的性质是
| A.在潮湿的空气中放置不易生锈 |
| B.硬度比生铁小 |
| C.与3 mol/L盐酸的反应生成氢气 |
| D.与18.4 mol/L的硫酸反应生成氢气 |
可用于判断NaHCO3粉末中混有Na2CO3的实验方法是
| A.加热时有气体放出 |
| B.滴加盐酸时有无气泡生成 |
| C.溶于水后滴加氯化钡溶液,有白色沉淀生成 |
| D.溶于水后滴加澄清石灰水,有白色沉淀生成 |
化学与社会生活联系非常的紧密,下列有关分析错误的是
| A.铝很活泼但在生活中应用广泛,是因为铝表面有一层致密的保护膜 |
| B.过氧化钠能应用在飞船中作供氧剂,是因为过氧化钠受热分解得到氧气 |
| C.节日燃放烟花呈现五彩缤纷的颜色,是因为发生了焰色反应 |
| D.铝盐和铁盐可用作净水剂,是因为A13+和Fe3+能直接与水中杂质反应 |
工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下: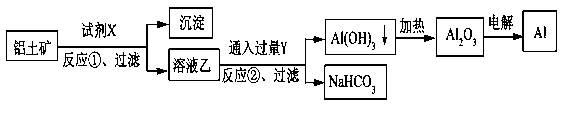
下列叙述正确的是( )
| A.试剂X可以是氢氧化钠溶液,也可以是盐酸 |
| B.反应①过滤后所得沉淀为氢氧化铁 |
| C.图中所示转化反应都不是氧化还原反应 |
| D.反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3 |
在含1 mol KAl(SO4)2的溶液中逐滴加入2 mol Ba(OH)2溶液,下列有关说法中正确的是( )
| A.先生成沉淀,后沉淀全部溶解 |
| B.当溶液中Ba2+全部沉淀出来时,沉淀的总物质的量最大 |
| C.最后得到的沉淀是BaSO4 |
| D.最后的沉淀为2 mol BaSO4、1 mol Al(OH)3 |