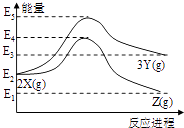
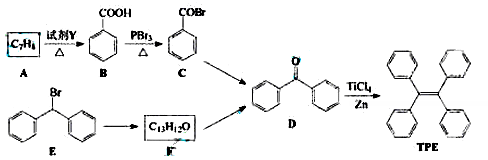
题目内容
【题目】新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2 , 电解质为KOH溶液.某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示. 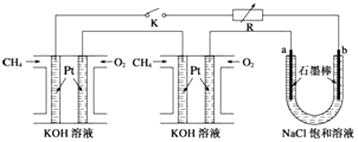
回答下列问题:
(1)甲烷燃料电池正极、负极的电极反应分别为、 .
(2)闭合K开关后,a、b电极上均有气体产生,其中b电极上得到的是 , 电解氯化钠溶液的总反应方程式为;
(3)若每个电池甲烷通入量为1L(标准状况),且反应完全,则理论上通过电解池的电量为(法拉第常数F=9.65×104 Cmol﹣1 , 列式计算),最多能产生的氯气体积为L(标准状况).
【答案】
(1)2O2+4H2O+8e﹣=8OH﹣;CH4+10OH﹣﹣8e﹣=CO32﹣+7H2O
(2)H2;2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
(3)![]() ×8×9.65×104C/mol=3.45×104C;4
×8×9.65×104C/mol=3.45×104C;4
【解析】解:(1.)在碱性溶液中,甲烷燃料电池的总反应式为:CH4+2O2+2OH﹣=CO32﹣+3H2O,正极是:2O2+4H2O+8e﹣═8OH﹣ , 负极是:CH4﹣8e﹣+10OH﹣═CO32﹣+7H2O.
所以答案是:2O2+4H2O+8e﹣=8OH﹣;CH4+10OH﹣﹣8e﹣=CO32﹣+7H2O;
(2.)b电极与通入甲烷的电极相连,作阴极,是H+放电,生成H2;电解氯化钠溶液的总反应方程式为:2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑,所以答案是:H2;2NaCl+2H2O
2NaOH+H2↑+Cl2↑,所以答案是:H2;2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑;
(3.)根据得失电子守恒,可得:1 mol CH4~8 mol e﹣~4 mol Cl2 , 故若每个电池甲烷通入量为1 L(标准状况),生成4L Cl2;电解池通过的电量为 ![]() ×8×9.65×l04Cmol﹣1=3.45×104C(题中虽然有两个燃料电池,但电子的传递量只能用一个池的甲烷量计算),所以答案是:
×8×9.65×l04Cmol﹣1=3.45×104C(题中虽然有两个燃料电池,但电子的传递量只能用一个池的甲烷量计算),所以答案是: ![]() ×8×9.65×104C/mol=3.45×104C;4.
×8×9.65×104C/mol=3.45×104C;4.

 阅读快车系列答案
阅读快车系列答案