题目内容
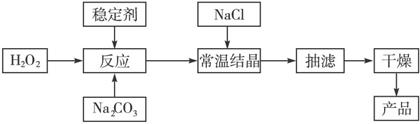
(选做题)【化学与技术模块】过碳酸钠俗称固体双氧水,被大量应用于洗涤、印染、纺织、造纸、医药卫生等领域中,它的制备原理和路线如下:2Na2CO3+ 3H2O2![]() 2Na2CO3·3H2O2 ΔH<0,回答下列问题:
2Na2CO3·3H2O2 ΔH<0,回答下列问题:
(1)与过碳酸钠的用途相关的化学性质是______________________。
(2)下列物质可使过碳酸钠较快失效的是________________________________。
A.MnO2 B.H2S C.稀硫酸 D.NaHCO3
(3)加入NaCl的作用是________________________________。
(4)工业纯碱中含有Fe3+等杂质,加入稳定剂的作用是与Fe3+生成稳定的配合物,Fe3+对反应的不良影响是________________________________。
(5)反应的最佳温度控制在15 ℃—
(6)以上生产流程中遗漏了一步,造成所得产品纯度偏低,该步操作的名称是____________。
(1)强氧化性(漂白性)
(2)ABC
(3)降低2 Na2CO3·3H2O2的溶解度,析出更多晶体
(4)催化双氧水的分解反应
(5)温度高时双氧水易分解 温度低时反应慢
(6)晶体的洗涤
解析:(1)过碳酸钠具有双氧水的性质,即具有强氧化性(漂白性)
(2)MnO2使过碳酸钠分解,H2S使之被还原,H2SO4与之反应生成CO2,因此选ABC。
(3)加入NaCl形成盐水溶液,能降低2Na2CO3·3H2O2的溶解度,便于析出更多晶体。
(4)Fe3+能催化H2O2的分解反应。
(5)温度高时H2O2易分解;温度较低时反应速率较慢。
(6)未洗去杂质而使产品纯度低,该步骤名称是洗涤。

 阅读快车系列答案
阅读快车系列答案



