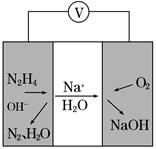
题目内容
下列叙述中正确的是( )
| A.相同条件下,N2和O3的混合气体与等体积的N2所含原子数相等 |
| B.标准状况下,28 g CO和22.4 L SO3所含分子数相等 |
| C.5.6 g铁粉与足量氯气充分反应,有0.2 mol电子转移 |
| D.等物质的量的CH5+和NH2—所含电子数相等 |
D
A项,O3为三原子分子,N2为双原子分子,相同条件下,等体积的N2,与N2和O3的混合气体所含分子数相同,故原子数一定不等;B项,标准状况下,SO3为固态,因此22.4 L SO3的物质的量远大于1 mol,而28 g CO的物质的量为1 mol,故二者所含分子数不等;C项,铁与氯气反应生成FeCl3,因此5.6 g铁粉(0.1 mol)与足量氯气反应转移电子0.3 mol; CH5+与NH2—中所含电子数均为10个,故等物质的量的CH5+与NH2—所含电子数相等。
点拨:本题考查物质结构、氧化还原反应等,考查考生的理解能力。难度中等。
本题易忽视标准状况下SO3为固态,误认为22.4 L SO3与28 g CO的物质的量均为1 mol而错选。
点拨:本题考查物质结构、氧化还原反应等,考查考生的理解能力。难度中等。
本题易忽视标准状况下SO3为固态,误认为22.4 L SO3与28 g CO的物质的量均为1 mol而错选。

练习册系列答案
相关题目
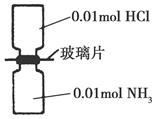
 2NH3(g) ΔH<0,其平衡常数K与温度T的关系如下表。
2NH3(g) ΔH<0,其平衡常数K与温度T的关系如下表。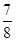 ,则N2的转化率为________,以NH3的浓度变化表示该过程的反应速率为________。
,则N2的转化率为________,以NH3的浓度变化表示该过程的反应速率为________。