题目内容
1.一定温度下,在固定体积的密闭容器中发生下列反应:2HI(g)?H2(g)+I2(g).若[HI]由0.1mol•L-1降到0.07mol•L-1时,需要15s,那么[HI]由0.07mol•L-1降到0.05mol•L-1时,所需反应的时间为( )| A. | 等于5 s | B. | 等于10 s | C. | 大于10 s | D. | 小于10 s |
分析 若c(HI)由0.1mol/L 降到0.07mol/L时,需要15s,即减少0.03mol/L需要15s;c(HI)由0.07mol/L 降到0.05mol/L时,浓度减少0.02mol/L,当速率与浓度变化成正比时,需要10s,但浓度越小,化学反应速率越小,需要的时间就长,以此来解答.
解答 解:若c(HI)由0.1mol/L 降到0.07mol/L时,需要15s,即减少0.03mol/L需要15s;
c(HI)由0.07mol/L 降到0.05mol/L时,浓度减少0.02mol/L,
当速率与浓度变化成正比时,需要$\frac{0.02mol/L}{0.03mol/L}$×15s=10s,
但浓度越小,化学反应速率越小,需要的时间就长,
所以需要时间大于10s,
故选C.
点评 本题考查了化学反应速率的影响因素,为高频考点,侧重于学生的分析能力的考查,注意浓度越大反应速率越大是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
18.用惰性电极电解饱和食盐水,如果阴极附近产生了8g的气体,则阳极产生的气体在标准状况下的体积是( )
| A. | 22.4L | B. | 44.8L | C. | 89.6L | D. | 1120L |
12.下列说法正确的是( )
| A. | 熔化状态下,能导电的物质一定是电解质 | |
| B. | 溶于水能导电的物质一定是电解质 | |
| C. | 熔化状态下,不能导电的化合物一定不是电解质 | |
| D. | BaSO4是强电解质 |
16.某烃不与溴水反应,能使酸性高锰酸钾溶液褪色,在Fe存在下与Cl2反应,能生成两种一氯代物,该烃是( )
| A. | CH≡C-CH3 | B. | 对二甲苯 | C. | 对甲乙苯 | D. | 邻甲乙苯 |
6.设NA为阿伏伽德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,33.6L氟化氢中含有氟原子的数目为1.5NA | |
| B. | 标准状况下,22.4LSO3含有NASO3个分子 | |
| C. | 46gNO2和N2O4混合气体中含有原子总数为3NA | |
| D. | 常温常压下,0.1molCl2溶于水,转移的电子数目为0.1NA |
13.有下列四种溶液:①NaOH溶液,②Mg(NO3)2溶液,③CuSO4溶液,④KCl溶液,不用其他试剂就能鉴别,正确的鉴别顺序是( )
| A. | ①②③④ | B. | ③④②① | C. | ④①②③ | D. | ③①②④ |
10.下列有关元素的性质或递变规律正确的是( )
| A. | ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物 | |
| B. | 第三周期主族元素从左到右,氧化物对应的水化物酸性依次增强 | |
| C. | 同主族元素的简单阴离子还原性越强,对应的简单氢化物沸点越高 | |
| D. | 同周期金属元素的主族序数越大,其原子失电子能力越强 |
11.常温下,下列各组离子或分子在指定溶液中能大量共存的是( )
| A. | pH=l的溶液中:Fe2+、Na+、S042-、N03- | |
| B. | 水电离的c(H+)=l×l0-13mol/L的溶液中:NH4+、K+、Cl-、HC03- | |
| C. | KMn04溶液中:H+、Na+、S042-、C2H50H | |
| D. | 使甲基橙变红色的溶液中:NH4+、Al3+、N03-、Cl- |
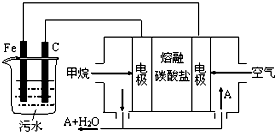 电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,除去浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,除去浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.