题目内容
化学是一门以实验为基础的自然科学,根据已有实验知识回答下列问题。
(1)下列说法错误的 。
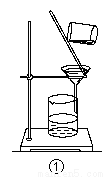
A.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
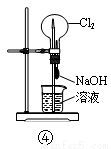
B.将Cl2通入紫色石蕊试液,溶液先变红后褪色
C.配制1L0.5mol·L-1的NaCl溶液,需用托盘天秤称量29.25gNaCl固体
D.常温下,可以用铁质容器储运浓硝酸
E.实验室保存硫酸亚铁溶液,需在试剂瓶内加入铁粉或铁钉,防止硫酸亚铁被氧化
F.实验室可以用加热氯化铵的方法制取少量氨气
(2)已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用如图所示的装置进行实验。实验过程中需从导管a处缓缓鼓入一定量的空气。
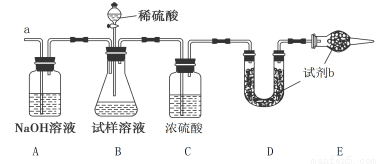
①装置E的名称 ,试剂b为 。
②实验过程中需要测定的数据除样品质量外有: (填序号)。
A.反应前后装置C的质量 B.反应前后装置D的质量 C.反应前后装置E的质量
③若去掉装置A,则测定结果 (填“偏高”“偏低”或“无影响”)。
(1)C F (2)①干燥管 碱石灰 ② B ③ 偏高
【解析】
试题分析:(1)A符合分液漏斗中液体放出的规则。正确。B. Cl2溶于水发生反应:Cl2+H2O HCl+HClO。产生的HCl和HClO都是酸,能使紫色石蕊试液变为红色,但由于HClO有强的氧化性,又会把红色氧化物无色。故将Cl2通入紫色石蕊试液,溶液先变红后褪色。正确。C.托盘天秤的准确度为0.1g,所以称量质量为29.3gNaCl固体.错误。D.在常温下,Fe遇到浓硫酸会被氧化产生一薄层致密的氧化物保护膜而阻止了金属继续被硝酸氧化。因此可以用铁质容器储运浓硝酸。正确。E.在常温下Fe2+容易被空气中的氧气氧化为Fe3+,如果变质,在实验室保存硫酸亚铁溶液时向溶液中加入铁粉或铁钉,就会发生反应:2Fe3++Fe== 3Fe2+,从而起到防止硫酸亚铁被氧化的作用。正确。F.NH4Cl
HCl+HClO。产生的HCl和HClO都是酸,能使紫色石蕊试液变为红色,但由于HClO有强的氧化性,又会把红色氧化物无色。故将Cl2通入紫色石蕊试液,溶液先变红后褪色。正确。C.托盘天秤的准确度为0.1g,所以称量质量为29.3gNaCl固体.错误。D.在常温下,Fe遇到浓硫酸会被氧化产生一薄层致密的氧化物保护膜而阻止了金属继续被硝酸氧化。因此可以用铁质容器储运浓硝酸。正确。E.在常温下Fe2+容易被空气中的氧气氧化为Fe3+,如果变质,在实验室保存硫酸亚铁溶液时向溶液中加入铁粉或铁钉,就会发生反应:2Fe3++Fe== 3Fe2+,从而起到防止硫酸亚铁被氧化的作用。正确。F.NH4Cl NH3+HCl.在试管口再发生反应: NH3+HCl= NH4Cl。因而不能用加热氯化铵的方法制取少量氨气。错误。选项为C F。(2)①装置E的名称为干燥管;在装置DE中盛装的为能够吸收二氧化碳气体的干燥剂碱石灰。②为测定试样中纯碱的质量分数只需要测定装置D在吸收二氧化碳气体前后的质量即可。故选项为B。③由于空气中也含有少量的二氧化碳气体,所以若去掉装置A,就会使一部分空气中的二氧化碳气体被当作为样品反应产生的产物而吸收,所以最终使测定结果偏高。
NH3+HCl.在试管口再发生反应: NH3+HCl= NH4Cl。因而不能用加热氯化铵的方法制取少量氨气。错误。选项为C F。(2)①装置E的名称为干燥管;在装置DE中盛装的为能够吸收二氧化碳气体的干燥剂碱石灰。②为测定试样中纯碱的质量分数只需要测定装置D在吸收二氧化碳气体前后的质量即可。故选项为B。③由于空气中也含有少量的二氧化碳气体,所以若去掉装置A,就会使一部分空气中的二氧化碳气体被当作为样品反应产生的产物而吸收,所以最终使测定结果偏高。
考点:考查物质纯度的测定及分液、称量、物质的保存、气体的制备等知识。

 名校课堂系列答案
名校课堂系列答案