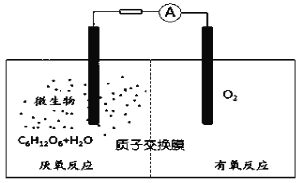
��Ŀ����
����Ŀ�����ԭ����ԭ���ԭ���ǵ绯ѧ��������Ҫ���ݡ�ij��ȤС��������̽�ʵ�飺
(1)������ͼlΪijʵ��С������������ԭ��Ӧ��Ƶ�ԭ���װ�ã��÷�Ӧ�����ӷ���ʽΪ_______����Ӧǰ���缫������ȣ�һ��ʱ������缫�������12g��������ͨ��______mol���ӡ�
(2)�����������䣬����CuCl2��Һ��ΪNH4Cl��Һ��ʯī�缫��Ӧʽ_______��
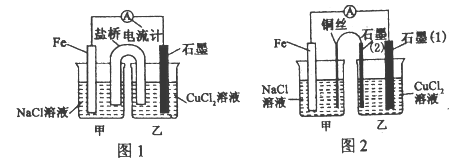
(3)������ͼ�������������䣬�������Ż�����ͭ������ʯī������n�ͣ���װ������ͭ��������ʯī(2)�缫�Ϸ����ķ�ӦʽΪ______________��
(4)����ͼ��װ���и�Ϊ����400 mLCuSO4��Һ��һ��ʱ�����ij�缫��������1.28 g�����ʱ��Һ��������Ũ��Ϊ__________����������Һ����ޱ仯��
���𰸡� Fe+Cu2+��Fe2++Cu 0.2 2H++2e-��H2�� 2Cl�D�D2e��=Cl2�� 1
����������1����Ƶ�ԭ���װ�õ��Է�������ԭ��Ӧ�ǣ�Fe+Cu2��=Cu+Fe2���������ת������x����64��0.5x+56��0.5x=12�����x=0.2��(2)�����������䣬����CuCl2��Һ��ΪNH4Cl��Һ��笠�����ˮ�����Һ��ʾ���ԣ�ʵ���ǣ�NH4��+H2O![]() NH3��H2O+H������������2H��+2e��=H2����(3)�����������䣬�������Ż�����ͭ������ʯī������n�ͣ�����װ���ǵ��أ���װ����ԭ��أ�Fe�Ǹ�����Cu˿������������������ͭ������ʯī�缫���������ü��Ϸ����ķ�ӦʽΪ2Cl��-2e��=Cl2������4��������Ӧ��Cu2��+2e��=Cu�����ü�����1.28g��0.02molʱ��ת�Ƶ�����0.04mol���ܷ�ӦʽΪ2CuSO4+2H2O
NH3��H2O+H������������2H��+2e��=H2����(3)�����������䣬�������Ż�����ͭ������ʯī������n�ͣ�����װ���ǵ��أ���װ����ԭ��أ�Fe�Ǹ�����Cu˿������������������ͭ������ʯī�缫���������ü��Ϸ����ķ�ӦʽΪ2Cl��-2e��=Cl2������4��������Ӧ��Cu2��+2e��=Cu�����ü�����1.28g��0.02molʱ��ת�Ƶ�����0.04mol���ܷ�ӦʽΪ2CuSO4+2H2O![]() 2Cu+2H2SO4+O2������֪����0.04molH������c��H����=0.04mol/0.4L=0.1mol��L��1��pH=1��
2Cu+2H2SO4+O2������֪����0.04molH������c��H����=0.04mol/0.4L=0.1mol��L��1��pH=1��

 ����ͼ���������������ϵ�д�
����ͼ���������������ϵ�д� ����ѧҵ���Ե�����ϵ�д�
����ѧҵ���Ե�����ϵ�д�