题目内容
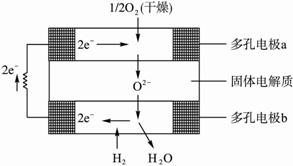
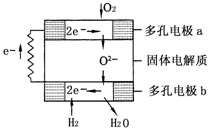 固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的.它以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )
固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的.它以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )分析:该电池属于酸性氢氧燃料电池,电池工作时的正负极反应式分别为:正极:O2+4e-=2O2-;负极:H2-2e-═2H+,总反应为:2H2+O2=2H2O.
解答:解:A、在燃料电池中,有O2放电的a极为原电池的正极,故A错误;
B、在燃料电池中,有H2放电的b极为电池的负极,故B错误;
C、a极对应的电极反应为:O2+4e-=2O2-,故C错误;
D、在燃料电池中,总反应方程式即为燃料燃烧的化学方程式,即2H2+O2=2H2O,故D正确.
故选D.
B、在燃料电池中,有H2放电的b极为电池的负极,故B错误;
C、a极对应的电极反应为:O2+4e-=2O2-,故C错误;
D、在燃料电池中,总反应方程式即为燃料燃烧的化学方程式,即2H2+O2=2H2O,故D正确.
故选D.
点评:本题考查原电池的工作原理,涉及正负极的判断,电极反应式的书写等问题,题目难度不大,注意基础知识的积累.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目