题目内容
以CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取乙醇的反应: 2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) -Q(Q>0)
CH3CH2OH(g)+3H2O(g) -Q(Q>0)
在密闭容器中,按H2与CO2的物质的量之比为3:1进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如下图所示。
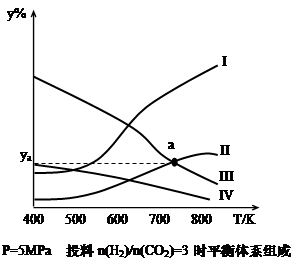
完成下列填空:
(1)表示CH3CH2OH体积分数曲线的是_______(选填序号)
(2)在一定温度下反应达到平衡的标志是_______(选填编号)
a.平衡常数K不再增大
b.CO2的转化率不再增大
c.混合气体的平均相对分子质量不再改变
d.反应物不再转化为生成物
(3)其他条件恒定,如果想提高CO2的反应速率,可以采取的反应条件是_______(选填编号);达到平衡后,能提高H2转化率的操作是_______(选填编号)
a.降低温度 b.充入更多的H2
c.移去乙醇 d.增大容器体积
(4)图中曲线II和III的交点a对应的体积分数ya=_______%
 CH3CH2OH(g)+3H2O(g) -Q(Q>0)
CH3CH2OH(g)+3H2O(g) -Q(Q>0)在密闭容器中,按H2与CO2的物质的量之比为3:1进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如下图所示。
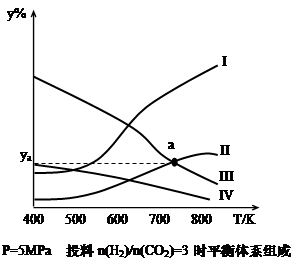
完成下列填空:
(1)表示CH3CH2OH体积分数曲线的是_______(选填序号)
(2)在一定温度下反应达到平衡的标志是_______(选填编号)
a.平衡常数K不再增大
b.CO2的转化率不再增大
c.混合气体的平均相对分子质量不再改变
d.反应物不再转化为生成物
(3)其他条件恒定,如果想提高CO2的反应速率,可以采取的反应条件是_______(选填编号);达到平衡后,能提高H2转化率的操作是_______(选填编号)
a.降低温度 b.充入更多的H2
c.移去乙醇 d.增大容器体积
(4)图中曲线II和III的交点a对应的体积分数ya=_______%
(1)II(2分)
(2)bc(2分)
(3)b(1分);c(1分)
(4)18.75(2分)
(2)bc(2分)
(3)b(1分);c(1分)
(4)18.75(2分)
试题分析:(1)反应过程中反应物逐渐减少,生成物逐渐增多,变化量的关系符合化学计量数比值,故Ⅰ、Ⅱ、Ⅲ、Ⅳ分别为H2O、CH3CH2OH、H2、CO2(g) ;
(2)遵循“变量不变达平衡”,a、温度不变平衡常数不变,错误;b、转化率从0到最大,是变量,不变时达到平衡,正确;c、气体的质量不变,容器的体积不变,混合气体的密度是定值,错误;d、平衡是动态平衡,每种物质的生成速率和消耗速率相等,错误;
(3)提高反应物的转化率可以改变温度使平衡正向移动,或增加另一种反应物的浓度,或移去产物;降低温度平衡正向移动,增大容器体积即是减少压强平衡正向移动,均提高反应物的转化率。
(4)曲线II和III对应的物质为乙醇和氢气,
2CO2(g)+6H2(g)
 CH3CH2OH(g)+3H2O(g)
CH3CH2OH(g)+3H2O(g)始量 1 3 0 0
转化量 2x 6x x 3x
平衡量 1-2x 3-6x x 3x
根据题意有 3-6x=x x=3/7 故a对应的体积分数ya=3/7÷(4-4×3/7)=0.1875

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目

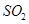 b.
b.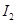 c.
c. d.HI
d.HI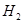 的物质的量随时间的变化如图所示。0~2min内的平均反应速率
的物质的量随时间的变化如图所示。0~2min内的平均反应速率 _________。
_________。
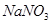 b.
b.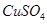 c.
c. d.
d.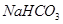
 CH3OH(g)+Q
CH3OH(g)+Q 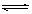 C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。
C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。
 C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是 cC(g)(△H<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
cC(g)(△H<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示: 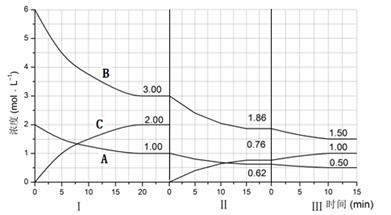
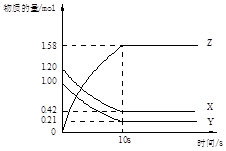
 Z(g)
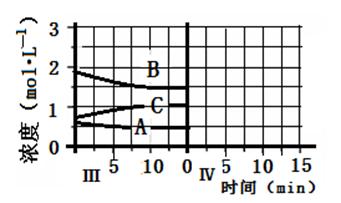
Z(g) n Z (g) △H > 0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。下列说法不正确的是
n Z (g) △H > 0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。下列说法不正确的是