题目内容
X、Y、Z均为元素周期表中前20号元素,mXa+、nYb-、Z(b+1)-简单离子的电子层结构相同,下列说法正确的是 ( )
| A.已知mXa+与nYb-,得m+a=n-b |
| B.离子半径:Yb->Z(b+1)-﹥Xa+ |
| C.Z(b+1)-的还原性一定大于Yb- |
| D.气态氢化物的稳定性Hb+1Z一定大于HbY |
C
试题分析:mXa+、nYb-、Z(b+1)-离子的电子层结构相同,则核外电子数相同,即m-a=n+b,X处于Y、Z的下一周期,X为金属元素,Y、Z为非金属元素,X的原子序数大于Y的原子序数,Y的原子序数大于Z的原子序数,结合电子层结构相同核电荷数越大离子半径越小与元素周期律判断。
A项:根据上述分析,m-a=n+b,故错;B项:具有电子层结构相同的离子,核电核数越大半径越小,故错;D项:Y的非金属性大于Z的非金属性,故错。故选C。
点评:本题考查了半径比较、核外电子排布、结构与位置关系,难度不大,判断W、Y的位置关系是关键,要灵活运用元素周期律知识解答。

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目

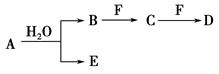
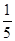 ,将B和D分别溶于水,所得溶液按恰当比例混合,可得一种不含金属元素的盐溶液,请写出A与H2O反应的化学方程式:_____________________________________;
,将B和D分别溶于水,所得溶液按恰当比例混合,可得一种不含金属元素的盐溶液,请写出A与H2O反应的化学方程式:_____________________________________;