题目内容
【题目】卤族元素(F、Cl、Br、I)是典型的非金属元素,它们的单质及化合物在生产生活中用途广泛。请回答下列问题:
(1)氟原子的价电子排布式为___,其原子核外电子能量最高轨道的电子云形状为__。
(2)同主族元素的第一电离能大小存在一定的规律,卤族元素(F、Cl、Br、I)中,第一电离能由大到小的顺序是___。
(3)氯元素价态多样,可以与氧元素形成多种阴离子,其中ClO3的空间构型为__,ClO4中氯原子的杂化方式为____,请写出一种与ClO4互为等电子体的微粒____。
(4)HF的相对分子质量小于HCl,但沸点却高于HCl,原因是____。
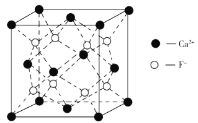
(5)CaF2的晶胞结构如图所示,其中氟离子的配位数是___。已知晶胞中相邻最近的两个Ca2+的核间距为anm,NA为阿伏加德罗常数的值,则晶胞的密度为___g·cm3。(列出计算式)
【答案】2s22p5 纺锤形(或哑铃形) F>Cl>Br>I 三角锥形 sp3 PO43-、CCl4等 HF分子间存在氢键,而HCl分子间不存在氢键 4 ![]()
【解析】
(1)氟原子的价电子为最外层电子,p轨道电子云形状为纺锤形(或哑铃形);
(2)同主族从上到下,随着原子半径的增大,原子核对价电子的吸引力减弱,故第一电离能依次减弱;
(3)根据价层电子互斥理论,判断杂化方式及空间构型;等电子体为含有相同原子总数和价电子总数的微粒;
(4)HF分子间形成氢键,使分子间作用力增大,其沸点升高;
(5)利用均摊法进行计算。
(1)氟原子的价电子为最外层电子,即2s22p5;核外电子能级最高的轨道为p轨道,其电子云形状为纺锤形(或哑铃形)。
(2)同主族从上到下,随着原子半径的增大,原子核对价电子的吸引力减弱,故第一电离能依次减弱;卤族元素(F、Cl、Br、I)中,第一电离能由大到小的顺序为F>Cl>Br>I。
(3)在ClO3-中价层电子对数3+![]() =4,氯原子采取sp2杂化,且含有1对孤电子对,空间构型为三角锥型;在
=4,氯原子采取sp2杂化,且含有1对孤电子对,空间构型为三角锥型;在![]() 中价层电子对数=4+
中价层电子对数=4+![]() =4,故氯原子采取sp3杂化;含有相同原子总数和价电子总数的等电子体有CCl4、PO43-。
=4,故氯原子采取sp3杂化;含有相同原子总数和价电子总数的等电子体有CCl4、PO43-。
(4)HF分子间形成氢键,使分子间作用力增大,其沸点升高,而HCl分子间不存在氢键。
(5)由CaF2晶胞可知,与每个F紧邻的Ca2+有4个,因而配位数为4。利用均摊法,在立方体晶胞中钙离子位于顶点和面心,数目为:8×![]() +6×
+6×![]() =4,氟离子位于体内,数目为8;相邻最近的两个Ca2+的核间距为a nm,则晶胞边长为
=4,氟离子位于体内,数目为8;相邻最近的两个Ca2+的核间距为a nm,则晶胞边长为![]() a nm。则晶胞的质量m=ρ·V=ρ×(
a nm。则晶胞的质量m=ρ·V=ρ×(![]() a)3×1021 cm3=
a)3×1021 cm3=![]() g,故
g,故![]() =
=![]() g·cm-3。
g·cm-3。