题目内容
7.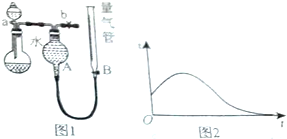 某同学利用图1装置,进行“铜和稀硝酸反应”的实验,可以达到不同目的.请回答相关问题:
某同学利用图1装置,进行“铜和稀硝酸反应”的实验,可以达到不同目的.请回答相关问题:(1)该反应的化学方程式为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O.
(2)若要制取少量N0气体,收集气体前必须先排出装置中的空气.
(3)图2为该反应的v-t关系图,试说明该反应的速率随时间变化的原因:反应放热,导致开始时反应速率加快,后来硝酸浓度变小,故反应速率变小.
(4)若要测定Cu的相对原子质量:
①反应前,先对量气管进行第一次读数,读数时,应注意的操作是:保持装置A和装置B液面相平,并使视线与凹液面最低处相平;
②反应后,待实验装置恢复至室温时时,再对量气管进行第二次读数;
③若测得Cu的相对原子质量不准,其原因可能是AC.
A.没有考虑分液漏斗中加人硝酸的体积
B.没有考虑到空气中的N2
C.没有考虑到空气中的O2与NO的反应.
分析 (1)铜和稀硝酸反应生成硝酸铜、一氧化氮、水.
(2)NO收集时必须排出装置中的空气;
(3)铜与硝酸反应放热,导致开始反应速率加快;后来硝酸浓度变小,反应速率变小;
(4)①读数时,要保持装置A和装置B液面相平,这样得到的数据比较准确;
②反应放热,气体会热胀冷缩;
③测得Cu的相对原子质量不准,是由于操作的失误导致所量取的NO的体积不准确导致的,据此分析.
解答 解:(1)铜和稀硝酸反应生成硝酸铜、一氧化氮、水,反应离子方程式为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,
故答案为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;
(2)NO收集时必须排出装置中的空气,否则会导致收集的NO气体不纯个,故答案为:排出装置中的空气;
(3)铜与硝酸反应放热,导致开始反应速率加快;后来反应速率变小是因为硝酸的浓度变小,故答案为:反应放热,导致开始时反应速率加快,后来硝酸浓度变小,故反应速率变小;
(4)①读数时,要保持装置A和装置B液面相平,这样得到的数据比较准确,
故答案为:保持装置A和装置B液面相平;
②反应放热,气体会热胀冷缩,故应等实验装置恢复至室温时,再对量气管进行第二次读数,故答案为:实验装置恢复至室温时;
③A.分液漏斗中加人的硝酸会导致收集到的气体NO的体积偏大,即计算出的铜的物质的量偏大,则铜的摩尔质量偏小,相对原子质量偏小,故A选;
B.空气中的N2对收集到的NO气体的体积无影响,则对计算出的铜的相对原子质量无影响,故B不选;
C.空气中的O2与NO的反应是个气体体积减小的反应,此反应的发生会导致收集到的气体体积偏小,则计算出的铜的物质的量偏小,则铜的摩尔质量和相对原子质量偏大,故C选.
故选AC.
点评 本题考查了根据反应来测定相对原子质量和制备气体,应注意的是用排水量气法来测量生成的气体的体积时应注意让气体恢复至室温和使两液面相平再读数.

| A. | 氮气可作贮存水果、粮食的保护气 | |
| B. | 氮的非金属性比磷强,所以氮气的化学性质比磷活泼 | |
| C. | 在雷雨天,空气中的N2和O2反应生成NO | |
| D. | 氮气既可作氧化剂,又可作还原剂 |
| A. | 500mL 0.4mol/L NaOH溶液 | B. | 400mL 0.15mol/L Na3PO4溶液 | ||
| C. | 300mL 0.5mol/L NaCl 溶液 | D. | 200mL 0.3mol/LNa2SO4 |
表中部分短周期元素的原子半径及主要化合价
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的稳定性为H2T<H2R | B. | 单质与稀盐酸反应的速率为L<Q | ||
| C. | M3+的离子半径比T2-的离子半径小 | D. | L2+与R2-的核外电子数相等 |
| A. | 1mol H2SO4的质量是98g•mol-1 | |
| B. | CO2的摩尔质量等于CO2的相对分子质量 | |
| C. | 0.012kg C-12里所含碳原子个数约为6.02×1023个 | |
| D. | 1mol任何物质的质量等于该物质的相对分子质量 |
| A. | 体积为11.2L | B. | 物质的量为0.5mol | ||
| C. | 含有6.02×1023个分子 | D. | 与1g H2的体积一定相同 |
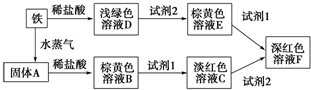 根据下列转化关系,回答有关问题:
根据下列转化关系,回答有关问题: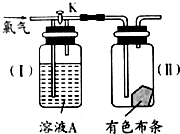 如图是一组探究氯气性质的装置.
如图是一组探究氯气性质的装置.