题目内容
若aAn+与bB2-两种离子的核外电子层结构相同,则a的数值为( )
| A.b+n+2 | B.b+n-2 | C.b-n-2 | D.b-n+2 |
A
试题分析:阳离子核外电子数=质子数-所带电荷数,所以aAn+的核外电子数为a-n;阴离子核外电子数=质子数+所带的电荷数,所以bB2-的核外电子数为b+2;aAn+与 bB2-两离子具有相同的电子层结构,说明二者核外电子数相同,所以a-n=b+2,即a=b+n+2。

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
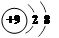 ,③
,③ 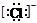 ,④F-,其核外电子数相同的是
,④F-,其核外电子数相同的是