题目内容
【题目】铁、铝的混合物进行如下实验: 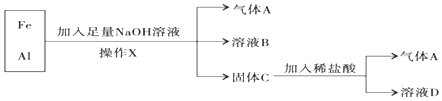
(1)操作X的名称是;
(2)气体A是(填化学式);
(3)加入足量NaOH溶液时发生反应的离子方程式为:;加入稀盐酸发生反应的离子方程式为:;
(4)向溶液D加入NaOH溶液,观察到产生的白色絮状沉淀迅速变为灰绿色,最终变为红褐色,请写出沉淀转化的化学方程式: .
【答案】
(1)过滤
(2)H2
(3)2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑; Fe+2H+=Fe2++H2↑
(4)4Fe(OH)2+O2+2H2O=4Fe(OH)3
【解析】解:(1)由上述分析可知,操作X分离不溶性固体与溶液,则名称为过滤,所以答案是:过滤;(2)由上述分析可知,气体A为H2,所以答案是:H2;(3)加入足量NaOH溶液时发生反应的离子方程式为2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑,加入稀盐酸发生反应的离子方程式为Fe+2H+=Fe2++H2↑,
所以答案是:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;Fe+2H+=Fe2++H2↑;(4)溶液D为FeCl2,向溶液D加入NaOH溶液,观察到产生的白色絮状沉淀迅速变为灰绿色,最终变为红褐色,该沉淀转化的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,
所以答案是:4Fe(OH)2+O2+2H2O=4Fe(OH)3.

练习册系列答案
相关题目





