��Ŀ����
����Ŀ����ȡ�Ȼ�����ĩ����֪�Ȼ�����ĩ��������ˮ���ɽᾧ������FeCl3+6H2O=FeCl3��6H2O��
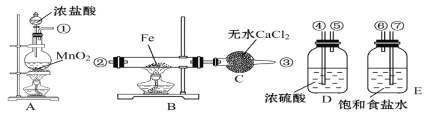
(1)�����������������˳����������Ӧ��(�������ӿ�˳��)���ٽ�___��___��___��___��___��
(2)��ƿA����������______(����������)��������Ӧ�����ӷ���ʽ_______________________�� B�з�Ӧ�Ļ�ѧ����ʽ_________________________________��
(3)����D��������_______________________������E��������_________________
(4)A��B�еľƾ���Ӧ�ȵ�ȼ_____��(�A����B��)�ľƾ��ƣ�������____________________
(5)����ʵ��װ���Ƿ�������_____(��ǡ���)���������������벹��___________װ��(����һ����ǡ�������ʲ���Ҫ����)��
���𰸡��� �� �� �� �� �������� MnO2 + 4H+ + 2Cl-![]() Mn2+ +Cl2 ��+2H2O 2Fe + 3Cl2
Mn2+ +Cl2 ��+2H2O 2Fe + 3Cl2 ![]() 2FeCl3 ��������(����ˮ��) ����Cl2�е�HCl���� A ʹ��ȡ�������ž�װ���ڵĿ��� �� β�����գ���ʢ��NaOH��Һ���ձ���
2FeCl3 ��������(����ˮ��) ����Cl2�е�HCl���� A ʹ��ȡ�������ž�װ���ڵĿ��� �� β�����գ���ʢ��NaOH��Һ���ձ���
��������
��1������ʵ��ԭ����Ŀ�ļ���װ�õ������ж�����������װ˳��
��2��A�ж������̺�Ũ���ᷴӦ�Ʊ������� MnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O��B������������Ӧ�����Ȼ������ݴ˽��
MnCl2+Cl2��+2H2O��B������������Ӧ�����Ȼ������ݴ˽��
��3������D��װ��Ũ���ᣬŨ���������ˮ�ԣ���������ã�����E���DZ��͵��Ȼ�����Һ����ϴȥ�����е��Ȼ��⣻
��4��A����ȡ������B������������Ӧ�������ȵ�A��ʹ��ȡ��Cl2�ž�װ���ڵĿ�������ֹ��������������������
��5�������ж������������ŷŵ������У�Ӧ����β������װ�ã�
��1����Aװ���Ʊ�����������ֱ�ͨ��Eʢ�б����Ȼ�����Һ��ϴ��ƿ��ȥ�����е��Ȼ���ٽӢߣ� ��Dʢ��Ũ�����ϴ��ƿ��ȥ�����е�ˮ�������ͽӢܣ����Ӹ�����Bװ���е�����Ӧ�ݽӢڣ�װ��C��ֹ�����е�ˮ�������룬����˳���Ǣߢޢܢݢڣ�
��2��A�ж������̺�Ũ���ᷴӦ�Ʊ������� MnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O����Ԫ�ػ��ϼ���+4����Ϊ+2������MnO2����������B������������Ӧ�����Ȼ�������Ӧ����ʽ��2Fe + 3Cl2
MnCl2+Cl2��+2H2O����Ԫ�ػ��ϼ���+4����Ϊ+2������MnO2����������B������������Ӧ�����Ȼ�������Ӧ����ʽ��2Fe + 3Cl2 ![]() 2FeCl3��
2FeCl3��
��3������D��װ��Ũ���ᣬŨ��������ˮ�ԣ��Ҳ���������Ӧ�����Կ���Ũ�����������������E���DZ��͵��Ȼ�����Һ��Ũ�����лӷ��ԣ����������к����Ȼ������壬�Ȼ��⼫������ˮ��ʳ��ˮ��Һ�е������������������ܽ⣬�����������ܽ�ȣ����Ա���ʳ��ˮ������������Cl2�е�HCl���壻
��4��A����ȡ������B������������Ӧ�������ȵ�A���ƾ��ƣ�����ȡ��Cl2�ž�װ���ڵĿ�������ֹ��������������������
��5�������ж�����Ⱦ��������������������������У���������ʵ��װ�ò������������ܺ��������Ʒ�Ӧ�����Ȼ��ơ��������ơ�ˮ�����Ի����������������ն��������װ�á�

����Ŀ����2L�ܱ������м���1molNO��1mol����̿��������Ӧ:2NO(g)+C(s) ![]() N2(g)+CO2(g) ��H = -213.5kJ/mol���ﵽƽ�����������:
N2(g)+CO2(g) ��H = -213.5kJ/mol���ﵽƽ�����������:
�¶�/�� | n(����̿)/mol | n(CO2)/mol |
T1 | 0.70 | ���� |
T2 | ���� | 0.25 |
����˵������ȷ���ǣ� ��
A. ������Ϣ����֪��T1<T2
B. T1��ʱ���÷�Ӧ��ƽ�ⳣ��K=9/16
C. T1��ʱ������ʼʱ��Ӧ�����������Сһ�룬ƽ���NO��ת���ʼ�С
D. T2��ʱ������Ӧ��ƽ�������С�����������c(N2)/c(NO)����


