题目内容
恒温、恒压下,在一个可变容积的容器中发生如下反应:A(g)+B(g)  C(g)
C(g)
(1)若开始时放入1 mol A+1 mol B,到达平衡后,生成a mol C,这时A的物质的量为________ mol.
(2)若开始时放入3 mol A和3 mol B,到达平衡后,生成C的物质的量为________ mol.
(3)若开始时放入x mol A,2 mol B和1 mol C,到达平衡后,A和C的物质的量分别为y mol和3a mol,则x=________mol,y=________mol.平衡时,B的物质的量________(选填一个编号).
(甲)大于2 mol (乙)等于2 mol (丙)小于2 mol (丁)可能大于、等于或小于2 mol
(4)若在(3)的平衡混合物中再加入3 mol C,待再次达到平衡后,C的物质的量分数是________.
 C(g)
C(g)(1)若开始时放入1 mol A+1 mol B,到达平衡后,生成a mol C,这时A的物质的量为________ mol.
(2)若开始时放入3 mol A和3 mol B,到达平衡后,生成C的物质的量为________ mol.
(3)若开始时放入x mol A,2 mol B和1 mol C,到达平衡后,A和C的物质的量分别为y mol和3a mol,则x=________mol,y=________mol.平衡时,B的物质的量________(选填一个编号).
(甲)大于2 mol (乙)等于2 mol (丙)小于2 mol (丁)可能大于、等于或小于2 mol
(4)若在(3)的平衡混合物中再加入3 mol C,待再次达到平衡后,C的物质的量分数是________.
(1)1-a (2)3a (3)2 3-3a 丁 (4)a/(2-a)
A(g)+B(g)  C(g)分子数改变,TV不变时各组分相同时等效平衡。TP不变比值相同就是等效平衡。分子数相等的反应无论是PT,TV都是比值相同为等效平衡。
C(g)分子数改变,TV不变时各组分相同时等效平衡。TP不变比值相同就是等效平衡。分子数相等的反应无论是PT,TV都是比值相同为等效平衡。
 C(g)分子数改变,TV不变时各组分相同时等效平衡。TP不变比值相同就是等效平衡。分子数相等的反应无论是PT,TV都是比值相同为等效平衡。
C(g)分子数改变,TV不变时各组分相同时等效平衡。TP不变比值相同就是等效平衡。分子数相等的反应无论是PT,TV都是比值相同为等效平衡。
练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
 2HI(g)△H=-9.48 kJ/mol
2HI(g)△H=-9.48 kJ/mol 
 xC(g) 符合下列图Ⅰ所示关系,由此推断对图Ⅱ的正确说法是( )
xC(g) 符合下列图Ⅰ所示关系,由此推断对图Ⅱ的正确说法是( )
 pC(g)+qD(g)的平衡常数为K,下列说法正确的是:
pC(g)+qD(g)的平衡常数为K,下列说法正确的是: 2NH3(g),现向一密闭容器中充入1molN2和3molH2,在高温、高压和催化剂存在条件下发生反应。下列有关说法正确的是( )
2NH3(g),现向一密闭容器中充入1molN2和3molH2,在高温、高压和催化剂存在条件下发生反应。下列有关说法正确的是( ) 2N2(g)+3H2O(g) △H<0。在恒容的密闭容器中,下列有关说法正确的是: ( )
2N2(g)+3H2O(g) △H<0。在恒容的密闭容器中,下列有关说法正确的是: ( ) A2B2(g) △H<0,下列说法正确的是( )
A2B2(g) △H<0,下列说法正确的是( ) 2C(g)。该反应进行到一定限度后达到了化学平衡,该化学平衡的标志是( )
2C(g)。该反应进行到一定限度后达到了化学平衡,该化学平衡的标志是( )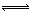 N2O4(g) △H<0。现欲测定二氧化氮的相对分子质量,应采取的措施是 ( )
N2O4(g) △H<0。现欲测定二氧化氮的相对分子质量,应采取的措施是 ( )