题目内容
【题目】实验室里通常用MnO2与浓盐酸反应制取氯气,为进行有关氯气的性质实验,需要4瓶容积为100 ml 的氯气。(常温下,氯气的密度为2.91g/L。)
(1)写出制取氯气的离子方程式。
(2)制取4瓶氯气,理论上需要MnO2固体的质量是多少?
(3)制取4瓶氯气,被氧化的HCl的物质的量是多少?
【答案】(1)MnO2+4H+ + 2Cl![]() Mn2+ + Cl2↑+2H2O
Mn2+ + Cl2↑+2H2O
(2)1.43 g
(3)0.032 mol
【解析】本题分析:本题主要考查有关实验室制氯气的计算。
(1)制取氯气的离子方程式:MnO2+4H+ + 2Cl![]() Mn2+ + Cl2↑+2H2O。
Mn2+ + Cl2↑+2H2O。
(2)4瓶氯气的质量为100mL×4×2.91g/L=1.164g,理论上需要MnO2固体的质量是(1.164×87/71)g=1.43g
(3)氯气的物质的量为n=![]() =
=![]() =0.016mol,被氧化的HCl的物质的量是0.032mol。
=0.016mol,被氧化的HCl的物质的量是0.032mol。

【题目】化学在日常生活中有着广泛的应用,下列对应关系不正确的是
实际应用 | 化学原因 | |
A | “84”消毒液和洁厕液不能混合使用 | 发生化学反应产生有毒气体 |
B | FeCl3腐蚀Cu刻制印刷电路板 | 铁比铜金属性强 |
C | 铝制餐具不宜用来蒸煮或长时间存放酸性、碱性或咸的食物 | 酸、碱还有盐等可直接侵蚀铝的保护膜以及铝制品本身 |
D | 明矾、硫酸铁可作净水剂 | 溶于水形成胶体从而凝聚水中的悬浮物 |
A. A B. B C. C D. D
【题目】蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成,由蛇纹石制取碱式碳酸镁的实验步骤如下:
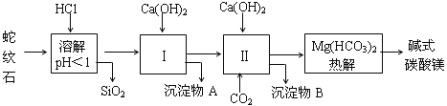
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是 。
(2)进行Ⅰ操作时,控制溶液的pH=7~8(有关氢氧化物沉淀的pH见下表),Ca(OH)2不能过量,若Ca(OH)2过量可能会导致 溶解,产生 沉淀。
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 1.5 | 3.3 | 9.4 |
(3)从沉淀混合物A中提取红色氧化物作为颜料,先向沉淀物A中加入 (填加入物质的化学式),然后 (依此填写实验操作名称)。物质循环使用,能节约资源。上述实验中,可以循环使用的物质是 (填写物质的化学式)。
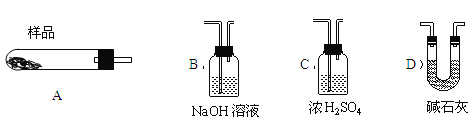
(4)现设计实验,确定产品aMgCO3·bMg(OH)2·cH2O中a、b、c的值。请写出下列实验步骤中所需要测定的项目(可用试剂:浓硫酸、碱石灰、氢氧化钠溶液、澄清石灰水):①样品称量,②高温分解,③ ,④ ,⑤MgO称量。
(5)从下列仪器(装有必要的试剂)中选择完成上述实验所必需的仪器,连接一套装置 (选择仪器代号,可重复使用,用“A→B→……→”表示)
(6)18.2g产品完全分解后,产生6.6gCO2和8.0gMgO,由此可知,产品的化学式中a= ,b= ,c= 。