��Ŀ����
����Ŀ��C1��ѧ�ֳ�һ̼��ѧ,�о��Ժ���һ��̼ԭ�ӵ�����Ϊԭ�Ϻϳɹ�ҵ��Ʒ���л���ѧ�����գ������ڲ��Ͽ�ѧ�Ϳ������ȼ�Ϸ������Ҫ�����ѷ�չ��Ϊһ��ѧ�ơ�ȼú�����е�CO��CO2����ת��Ϊ��������ԭ�ϡ������Դ�״���
��3H2(g)+CO2(g)![]() CH3OH(g) + H2O(l) ��H1
CH3OH(g) + H2O(l) ��H1
��CO(g)+2H2(g)![]() CH3OH(g) ��H2
CH3OH(g) ��H2
������֪��18gˮ�������Һ̬ˮ�ų�44KJ��������
��ѧ�� | C-H | C-O | C=O | H-H | O-H |
����/KJ/mol | 412 | 351 | 745 | 436 | 462 |
����H1_____________________
����һ�������£��ں��ݵ��ܱ�������Ͷ��1molCO ��2mol H2����Ӧ���ڴ��������³�ַ�Ӧ��CH3OH��ƽ�������е���������ڲ�ͬѹǿ�����¶ȵı仯��ͼl��ʾ��
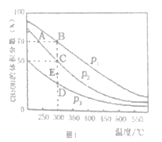
��1��ͼ��ѹǿ����Դ�С��P1______P2������>����<������=�������жϵ�������________
��2��A��B��C����Ļ�ѧƽ�ⳣ������Դ�СK(A)______K(B)_____ K(C)������>����<������=��) ������C���ѹǿƽ�ⳣ��Kp=__________����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����������
��3��300����P2�����£�����E��ʱV��________V��������>����<������=����
��4��ij�¶��£�����˵���÷�Ӧ�����ﵽƽ��״̬����______________��
a�������ڵ��ܶȲ��ٱ仯
b. ����֮��v(CO):v(H2): v(CH3OH��=l: 2:l
c����������������������ٱ仯
d. �����ڻ�������ƽ����Է����������ٱ仯
e�������ڸ���ֵ������������ٱ仯
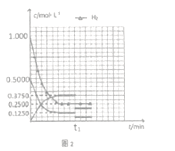
��5����Ӧ��ʼ����C���ƽ�⣬�����ʵ�Ũ����ʱ��仯������ͼ2��ʾ�������¶Ȳ��䣬t1ʱ�ı�����Ϊ_________����ʱƽ��_______�������������ƶ����������ƶ��������ƶ��� )
��.��ҵ�Ͽ�ͨ����ȩ�ʻ�������ȡ���������25��ʱ���䷴Ӧ���Ȼ�ѧ����ʽΪ��CH3OH(g)+CO(g) ![]() HCOOCH3(g)�������о�����ͼ��ʾ��
HCOOCH3(g)�������о�����ͼ��ʾ��
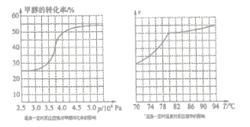
�����ݷ�Ӧ��ϵ��ѹǿ�Լ״�ת���ʵ�Ӱ�첢�ۺϿ��������ɱ����ص���_____�������������ĸ��
a. 3.5��106Pa b. 4.0��106Pac. 5.0��106Pa
��������������ȡ���������ʵ�ʹ�ҵ�����У����õ��¶���80������������_______
���𰸡� -219KJ/mol > ��ͼ���֪�����¶Ȳ���ʱ��P1�����´�ƽ��CH3OH������������Ӧ������Ϊ���������С�ķ�Ӧ��������������ʱ����ѹƽ�������ƶ���CH3OH������������� > = 27/P22 > ab ͨH2����H2Ũ�Ȳ��䣬�����������Ϊԭ�������� ƽ�ⲻ�ƶ� b ����80����Ӧ���ʽ�С������80���¶ȶԷ�Ӧ����Ӱ���С������ӦΪ���ȷ�Ӧ�������¶�ƽ������ת�ƣ�ת���ʽ���
����������Ӧ�ȣ���Ӧ�����֮�ͣ����������֮�ͣ�����Ϊ18gˮ�������Һ̬ˮ�ų�44kJ�����������H1����3��436+2��745��3��412��351��462��2��462-44��kJ/mol����219kJ/mol��
��1����ͼ���֪�����¶Ȳ���ʱ��P1�����´�ƽ��CH3OH������������Ӧ������Ϊ���������С�ķ�Ӧ��������������ʱ����ѹƽ�������ƶ���CH3OH�����������������P1��P2����2������ͼ���֪�����¶ȼ״��������ͣ���������Ӧ�Ƿ��ȷ�Ӧ��A���¶ȵ���B�㣬B��C���¶���ͬ���������ӦA��B��C����Ļ�ѧƽ�ⳣ������Դ�СK(A)��K(B)��K(C)��C��״�����Ϊ0.5��
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
��ʼ����mol�� 1 2 0
ת������mol�� x 2x x
ƽ������mol�� 1-x 2-2x x
��![]() �����x��0.75������C���ѹǿƽ�ⳣ��Kp=
�����x��0.75������C���ѹǿƽ�ⳣ��Kp=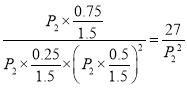 ����3��300�棬P2�����£�E��Ҫ�ﵽƽ��״̬�״��ĺ������ߣ�ƽ��������Ӧ������У�����E��ʱV����V������4��a���ܶ��ǻ��������������ݻ��ı�ֵ���ڷ�Ӧ�����ж��߾����䣬���������ڵ��ܶȲ��ٱ仯����˵����Ӧ�ﵽƽ��״̬��a����b. ����֮��v(CO):v(H2): v(CH3OH��=l: 2:l����˵�����淴Ӧ������ȣ���һ������ƽ��״̬��b����c����������������������ٱ仯˵����Ӧ�ﵽƽ��״̬��c��ȷ��d. �������ƽ����Է��������ǻ�����������ͻ�������ܵ����ʵ����ı�ֵ���������䣬�����ʵ����DZ仯�ģ����������ڻ�������ƽ����Է����������ٱ仯˵����Ӧ�ﵽƽ��״̬��d��ȷ��e�������ڸ���ֵ������������ٱ仯˵����Ӧ�ﵽƽ��״̬��e��ȷ����ѡab����5������ͼ���֪����Ũ�Ȳ��䣬���������ʵ�Ũ�ȱ�Ϊԭ����1/2�����Ա����¶Ȳ��䣬t1ʱ�ı�����ΪͨH2����H2Ũ�Ȳ��䣬�����������Ϊԭ������������ʱŨ������Ȼ����ƽ�ⳣ�������ƽ�ⲻ�ƶ���
����3��300�棬P2�����£�E��Ҫ�ﵽƽ��״̬�״��ĺ������ߣ�ƽ��������Ӧ������У�����E��ʱV����V������4��a���ܶ��ǻ��������������ݻ��ı�ֵ���ڷ�Ӧ�����ж��߾����䣬���������ڵ��ܶȲ��ٱ仯����˵����Ӧ�ﵽƽ��״̬��a����b. ����֮��v(CO):v(H2): v(CH3OH��=l: 2:l����˵�����淴Ӧ������ȣ���һ������ƽ��״̬��b����c����������������������ٱ仯˵����Ӧ�ﵽƽ��״̬��c��ȷ��d. �������ƽ����Է��������ǻ�����������ͻ�������ܵ����ʵ����ı�ֵ���������䣬�����ʵ����DZ仯�ģ����������ڻ�������ƽ����Է����������ٱ仯˵����Ӧ�ﵽƽ��״̬��d��ȷ��e�������ڸ���ֵ������������ٱ仯˵����Ӧ�ﵽƽ��״̬��e��ȷ����ѡab����5������ͼ���֪����Ũ�Ȳ��䣬���������ʵ�Ũ�ȱ�Ϊԭ����1/2�����Ա����¶Ȳ��䣬t1ʱ�ı�����ΪͨH2����H2Ũ�Ȳ��䣬�����������Ϊԭ������������ʱŨ������Ȼ����ƽ�ⳣ�������ƽ�ⲻ�ƶ���
��.�ٸ���ͼ���֪ 4.0��106Paʱ�״���ת�����Ѿ��ܸߣ�������ѹǿת���ʱ仯���������������ɱ������Դ�ѡb���ڵ���80����Ӧ���ʽ�С������80���¶ȶԷ�Ӧ����Ӱ���С������ӦΪ���ȷ�Ӧ�������¶�ƽ������ת�ƣ�ת���ʽ��ͣ������ȡ���������ʵ�ʹ�ҵ�����У����õ��¶���80�档


