题目内容
【题目】某实验小组对氯水成分和性质进行研究,实验如下:
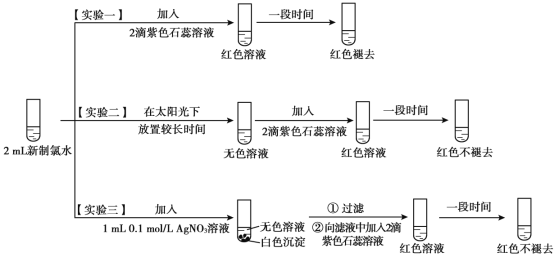
(1)氯水呈黄绿色,说明其中含有_________(填化学式)。
(2)实验一的现象表明,氯水具有酸性和_________性。
(3)氯气与水反应的化学方程式为__________。
(4)用化学用语说明实验二中“红色不褪去”的原因_______。
(5)实验四证明了实验三中“红色不褪去”不是因为氯水被稀释所致,补充所加试剂和现象。
(实验四)
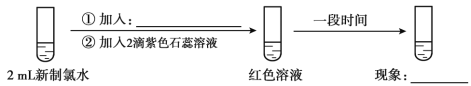
①加入:____________,现象:___________;
(6)进一步探究实验三中“红色不褪去”的原因。
(实验五)取实验三的白色沉淀,洗涤,用饱和氯化钠溶液浸泡,取上层清液,滴加2滴紫色石蕊溶液,一段时间后,颜色褪去。写出氯水和硝酸银溶液反应的化学方程式______。
【答案】Cl2 漂白或氧化 Cl2 + H2O![]() HCl + HClO 2HClO
HCl + HClO 2HClO![]() 2HCl + O2↑ 1 mL蒸馏水 红色褪去 Cl2 + 2AgNO3 + H2O =AgCl↓ + AgClO↓ + 2HNO3
2HCl + O2↑ 1 mL蒸馏水 红色褪去 Cl2 + 2AgNO3 + H2O =AgCl↓ + AgClO↓ + 2HNO3
【解析】
氯气溶于水发生反应Cl2+H2O![]() HCl+HClO,新制氯水含有Cl2、H2O、HClO、H+、Cl-、ClO—、OH—等粒子,能表现Cl2、HClO、H+、Cl-等微粒的性质。
HCl+HClO,新制氯水含有Cl2、H2O、HClO、H+、Cl-、ClO—、OH—等粒子,能表现Cl2、HClO、H+、Cl-等微粒的性质。
(1)氯水溶于水,溶于水的氯气部分与水反应生成盐酸和次氯酸,溶液呈黄绿色,说明溶液中含有Cl2分子,故答案为:Cl2;
(2)实验一中加入石蕊试液变红色,表明溶液呈酸性,溶液红色褪去,说明氯水具有强氧化性而表现漂白性,故答案为:漂白或氧化;
(3)氯气与水反应生成盐酸和次氯酸,反应的化学方程式为Cl2 + H2O![]() HCl + HClO,故答案为:Cl2 + H2O
HCl + HClO,故答案为:Cl2 + H2O![]() HCl + HClO;
HCl + HClO;
(4)实验二中新制氯水在太阳光下放置较长时间,次氯酸遇光分解生成盐酸和氧气,反应的化学方程式为2HClO![]() 2HCl + O2↑,故答案为:2HClO
2HCl + O2↑,故答案为:2HClO![]() 2HCl + O2↑;
2HCl + O2↑;
(5)由题意可知实验四证明了实验三中“红色不褪去”不是因为氯水被稀释,所以①加入1 mL蒸馏水,稀释后继续加入石蕊试液变红色,一段时间后溶液红色又褪去,故答案为:1 mL蒸馏水;红色褪去;
(6)取实验三的白色沉淀,洗涤,用饱和氯化钠溶液浸泡,取上层清液,滴加2滴紫色石蕊溶液,一段时间后,颜色褪去说明白色沉淀中含有次氯酸银沉淀,说明新制氯水与硝酸银溶液反应生成氯化银和次氯酸银白色沉淀和硝酸,反应的化学方程式为Cl2 + 2AgNO3 + H2O =AgCl↓ + AgClO↓ + 2HNO3,故答案为:Cl2 + 2AgNO3 + H2O =AgCl↓ + AgClO↓ + 2HNO3。

【题目】过氧化钙(CaO2)常用作种子及谷物的无毒性消毒剂,常温下为白色的固体,微溶于水,且不溶于乙醇、乙醚和碱性溶液,但溶于酸。
某实验小组拟探究CaO2的性质及其实验室制法。
(1)实验探究CaO2与酸的反应。
操作 | 现象 |
向盛有4 g CaO2的大试管中加入10mL稀盐酸得溶液a | 剧烈反应,产生能使带火星木条复燃的气体 |
取5 mL溶液a于试管中,滴入两滴石蕊试液 | 溶液变红,一段时间后溶液颜色明显变浅,稍后,溶液变为无色 |
①CaO2与盐酸反应的化学方程式为_______________________________。
②加入石蕊试液后溶液褪色可能是因为溶液a中存在较多的_________。
(2)用如图所示装置制备过氧化钙,其反应原理为Ca+O2![]() CaO2。
CaO2。
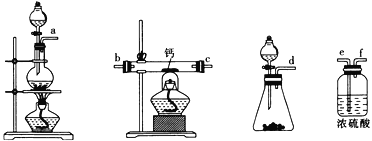
①请选择实验所需要的装置,按气流方向连接的顺序为______________________(填仪器接口的字母,上述装置可不选用也可重复使用)。
②根据完整的实验装置进行实验,实验步骤如下:Ⅰ.检验装置的气密性后,装入药品;Ⅱ.打开分液漏斗活塞,通入气体一段时间,加热药品;Ⅲ.反应结束后,_________________________________(填操作);Ⅳ.拆除装置,取出产物。
(3)利用反应:Ca2++ H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4+在碱性环境下制取CaO2的装置如图所示。

①NH3在Ca2+和H2O2的反应过程中所起的作用是______________________。
②反应结束后,经过滤、洗涤、低温烘干可获得CaO2·8H2O。过滤需要的玻璃仪器是_________;将沉淀进行洗涤的操作为_____________________________________________。
(4)设计实验证明CaO2的氧化性比FeCl3的氧化性强:____________________________。
【题目】2019年是元素周期表诞生150周年,元素周期表(律)在学习、研究和生产实践中有很重要的作用。下表为元素周期表的一部分,回答下列问题。
族 周期 | IA | 0 | ||||||
1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
2 | ② | ③ | ||||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ||||||||
(1)元素①~⑧中,金属性最强的是________(填元素符号)。
(2)中国青年化学家姜雪峰被国际组织推选为“元素⑦代言人”,元素⑦的原子结构示意图是________,其氢化物的电子式是_________。
(3)元素①和②可以形成多种化合物。下图模型表示的分子中,不可能由①和②形成的是_______(填序号)。
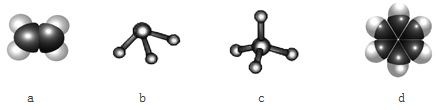
(4)比较元素②、③的最高价氧化物对应水化物的酸性:______>______(填化学式)。说明你判断的理由:_________。
(5)主族元素砷(As)的部分信息如图所示。
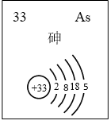
i.砷(As)在周期表中的位置是______。
ii.下列说法正确的是_______(填序号)。
a. 砷元素的最高化合价为+4
b. 推测砷有多种氧化物
c. ③的气态氢化物的还原性大于砷的气态氢化物的还原性
(6)某小组同学设计实验比较VIIA元素的非金属性:Cl>Br>I。
已知:常温下浓盐酸与高锰酸钾反应生成氯气。
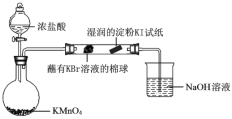
打开分液漏斗的活塞,烧瓶中产生黄绿色气体,蘸有KBr溶液的棉球变为橙红色,湿润的淀粉KI试纸变蓝,据此现象能否说明非金属性:Br > I,并说明理由_________。