题目内容
【题目】下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ |
(1)写出下列元素的元素符号: ④_________、⑧ __________(填具体元素符号,下同);⑤正一价阳离子的结构示意图是________________。
(2)最高价氧化物是两性氧化物的元素是___________;它的最高价氧化物对应水化物与⑤的最高价氧化物对应水化物溶液反应的离子方程式为_______________________________。
(3)①、②两元素形成的最简单化合物的结构式为________________________,该化合物是由_________(填“极性”“非极性”)键形成的。
(4)④⑦二种元素中非金属性强的是___________。
(5)检验元素⑨的方法是_______________________。
【答案】O Cl ![]() Al Al(OH)3+OH-=AlO2-+2H2O
Al Al(OH)3+OH-=AlO2-+2H2O 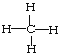 极性 O 焰色反应
极性 O 焰色反应
【解析】
根据元素在元素周期表中的位置可知,①为H元素,②为C元素,③为N元素,④为O元素,⑤为Na元素,⑥为Al元素,⑦为S元素,⑧为Cl元素,⑨为K元素,据此结合题干分析解答问题。
(1)根据上述分析可知,④为O元素,⑧为Cl元素,⑤为Na元素,Na的核电数为11,其正一价阳离子的结构示意图为![]() ,故答案为:O、Cl、
,故答案为:O、Cl、![]() ;
;
(2)①~⑨的元素中,Al元素的最高价氧化为Al2O3既能和酸反应,又能和强碱反应,是两性氧化物,其最高价氧化物对应水化物为Al(OH)3,⑤的最高价氧化物对应水化物为NaOH,两者反应的离子反应方程式为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al;Al(OH)3+OH-=AlO2-+2H2O;
(3)C、H两元素形成的最简单化合物为CH4,其结构简式为 ,该分子中C原子和H原子形成极性共价键,故答案为:
,该分子中C原子和H原子形成极性共价键,故答案为: ;极性;
;极性;
(4)O和S两种元素中,O的原子半径小于S,非金属更强,故答案为:O;
(5)元素⑨为K元素,由于K元素的焰色反应为紫色(需透过蓝色钴玻璃),因此可通过焰色反应来检验K元素,故答案为:焰色反应。

 名校课堂系列答案
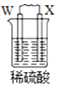
名校课堂系列答案【题目】由W、X、Y、Z四种金属按下列装置进行实验。下列说法不正确的是
甲 | 乙 | 丙 | |
装置 |
|
|
|
现象 | 金属W不断溶解 | Y 的质量增加 | W上有气体产生 |
A.四种金属的活动性强弱顺序为Z>W>Y>X
B.装置乙中Y电极上的反应式为Cu2++2e=Cu
C.装置甲中X作原电池正极
D.装置丙中溶液的c(H+)减小