题目内容
原电池正、负电极的极性不仅与电极材料的性质有关,也与电解质溶液有关。下列由不同材料组成的原电池,电极反应正确的是
| A.由Fe、Cu与稀硫酸组成的原电池,其负极反应式为Fe-3e-=Fe3+ |
| B.由Al、Mg与氢氧化钠溶液组成的原电池,其负极反应式为:Mg-2e-+2OH-=Mg(OH)2 |
| C.Pb、Cu与氯化铁溶液组成的原电池,其正极反应式为Cu-2e-=Cu2+ |
| D.Al、Cu与浓硝酸组成的原电池,其负极反应式为Cu-2e-=Cu2+ |
D
解析试题分析:原电池中较活泼的金属做负极,不活泼的金属做正极,但在实际判断时还需要考虑电解质溶液的性质。A、由Fe、Cu与稀硫酸组成的原电池中铁的金属性强于铜,且铁能和稀硫酸反应,因此其负极是铁,则负极反应式为Fe-2e-=Fe2+,A不正确;B、由Al、Mg与氢氧化钠溶液组成的原电池,镁的金属性强于铝,但能和氢氧化钠溶液反应的是铝,因此铝是负极,镁是正极,则负极反应式为Al-3e-+4OH-=AlO2-+2H2O,B不正确;C、Pb、Cu与氯化铁溶液组成的原电池中铜的金属性强于铅,因此铜是负极,铅是正极,则正极反应式为Fe3+-2e-=Fe2+,C不正确;D、Al、Cu与浓硝酸组成的原电池中铝比铜活泼,但常温下铝在浓硝酸中钝化,因此铝是正极,铜是负极,其负极反应式为Cu-2e-=Cu2+,D正确,答案选D。
考点:考查原电池正负极以及电极反应式的书写判断

被称为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰。在纸内的离子“流过”水和氧化锌组成的电解液。总反应的化学方程式为:Zn+2MnO2+H2O=Zn(OH)2+Mn2O3,下列说法错误的是( )
| A.电池工作时,锌失去电子 |
| B.外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.电池正极的电极反应式为:2MnO2+H2O+2e-= Mn2O3+2OH- |
某小组为研究电化学原理,设计如图装置。下列叙述不正确的是( )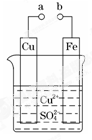
| A.a 和 b 不连接时,铁片上会有金属铜析出 |
| B.a 和 b 用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu |
| C.无论 a 和 b 是否连接,铁片均会溶解,溶液均从蓝色逐渐变 成浅绿色 |
| D.a 和 b 分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动 |
下图甲池和乙池中的四个电极都是铂电极,乙池溶液分层,上层溶液为盐溶液,呈中性。请根据图示判断下列有关说法正确的是: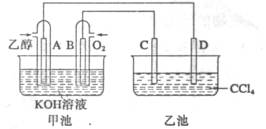
| A.甲池的电解池,乙池是原电池 |
| B.通入乙醇的铂电极反应式为C2H5OH+16OH-+12e-=2CO32-+11H2O |
| C.反应一段时间后,两池溶液的pH均未变化 |
| D.假如乙池中加入NaI溶液,则在乙池反应过程中,可以观察到C电极周围的溶液呈现棕黄色,反应完毕后,用玻璃棒搅拌溶液,则下层溶液呈现紫红色,上层接近无色 |
如图所示,将铁棒和石墨棒插入1L 1mol﹒L-1食盐水中。下列说法正确的是( )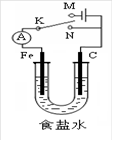
| A.若电键K与N连接,铁被保护不会腐蚀 |
| B.若电键K与N连接,正极反应式是4OH- -4e-=2H2O+O2↑ |
| C.若电键K与M连接,将石墨棒换成铜棒可实现铁棒上镀铜 |
| D.若电键K与M连接,当两极共产生28 L(标准状况)气体时,生成1 mol NaOH |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是
| A.放电时锌作负极 |
| B.充电时氢氧化铁被氧化 |
| C.放电时溶液的碱性增强 |
| D.充电时转移3 mol e-,有2 mol FeO42-被还原 |
X、Y、Z、M代表四种金属元素。金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有氢气放出;若电解Y2+和Z2+离子共存的溶液时,Y先析出;又知M2+离子的氧化性强于Y2+离子。则这四种金属的活动性由强到弱的顺序为
| A.M>Z>X>Y | B.X>Y>Z>M | C.X>Z>Y>M | D.X>Z>M>Y |
下列关于化学能与电能相互转化的说法正确的是
| A.在原电池中,化学能转变为电能,电子沿导线由正极流向负极 |
| B.双液原电池通过盐桥连接,KCl盐桥中K+朝正极定向迁移 |
| C.在电解池中,与电源负极相连的电极称为阳极,溶液中阴离子朝阳极定向迁移 |
| D.电解氯化铜溶液,在阴极上产生的气体能使湿润的KI-淀粉试纸变蓝 |
SO2通过下列工艺流程可制化工业原料H2SO4和清洁能源H2。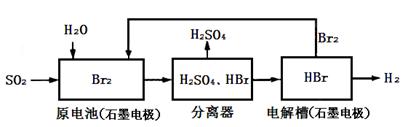
下列说法中正确的是
| A.电解槽中也可以用铁电极代替石墨作为阳极 |
| B.原电池中负极的电极反应为:SO2+2H2O+4e-=SO42-+4H+ |
| C.该工艺流程用总反应的化学方程式表示为:SO2+Br2+2H2O=2HBr+H2SO4 |
| D.该生产工艺的优点Br2被循环利用,原电池产生的电能可充分利用,还能获得清洁能源 |