题目内容
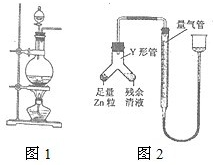
实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如下图所示).

1.制备实验开始时,先检查装置气密性,接下来的操作依次是(填序号).
A.往烧瓶中加入MnO2粉末
B.加热
C.往烧瓶中加入浓盐酸
制备反应会因盐酸浓度下降而停止.为测定已分离出过量MnO2后的反应残余液中盐酸的浓度,探究小组同学提出的下列实验方案∶
甲方案∶与足量AgNO3溶液反应,称量生成的AgCl质量.
乙方案∶与已知量CaCO3(过量)反应,称量剩余固体的质量.
丙方案∶与足量Zn反应,测量生成的H2体积.
继而进行下列判断和实验∶
2.判定甲方案不可行,理由是________.
3.乙方案的实验发现,固体中含有MnCO3,说明碳酸钙在水中存在________,测定的结果会∶(填“偏大”、“偏小”或“准确”).
进行丙方案实验∶装置如下图所示(夹持器具已略去).

4.使Y形管中的残余清液与锌粒反应的正确操作是将转移到________中.
5.反应完毕,每间隔1分钟读取气体体积,发现气体体积逐渐减小,直至不变.气体体积逐次减小的原因是________(排除装置和实验操作的影响因素).
6.小组内又有同学提出还可采用酸碱中和滴定法测定残余液中盐酸的浓度,但还需经查阅资料知道∶________.
答案:
解析:
解析:
1.ACB
2.残余溶液中,只能计算出Cl-的量,而不能算出H+的量,且n(Cl-)>n(H+)
3.溶解平衡,偏小
4.Zn粒;残余清液(按序写出两项)
5.装置内气体尚未冷至室温
6.Mn2+开始沉淀时的PH

练习册系列答案
相关题目
 (2012?福建)实验室常用MnO2与浓盐酸反应制备Cl2(发生装置如图1所示).
(2012?福建)实验室常用MnO2与浓盐酸反应制备Cl2(发生装置如图1所示).
 实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1所示).
实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1所示). (1)制备实验开始时,先检查装置气密性,接下来的操作依次是 (填序号)。
(1)制备实验开始时,先检查装置气密性,接下来的操作依次是 (填序号)。 ③判断丙方案的实验结果 (填“偏大”、“偏小”或“准确”)。
③判断丙方案的实验结果 (填“偏大”、“偏小”或“准确”)。