题目内容
(14分)Ⅰ.反应物与生成物有:浓H2SO4、K2S、K2SO4、SO2、H2O和一种未知物质X。
(1)已知K2S在反应中失去电子,则该反应的氧化剂是 。
(2)已知0.5molK2S在反应中失去1mol电子生成X,则X的化学式为 。
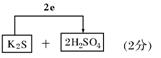
(3)将氧化剂和还原剂及其配平后系数填入下列空格中,并标出电子转移的方向和数目:
![]()
(4)若反应中浓H2SO4过量,则 产物中无X生成,请完成此化学反应方程式: 。
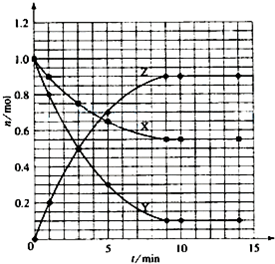
Ⅱ.短周期元素X、Y、Z的原子序数依次增大,X和Y同主族,Y和Z同周期,Y与Z能形成离子个数比为1﹕1的离子化合物A,X与Z能形成原子个数比为1﹕1的共价化合物B,它们之间能实现如图所示转化(部分产物已略去):
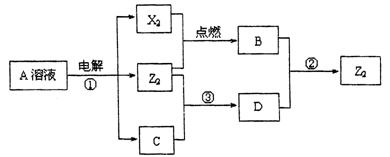
(1)Y在周期表的位置是 ;
(2)反应①的化学方程式是 。
(3)D溶液呈碱性的原因是(用离子方程式表示) 。
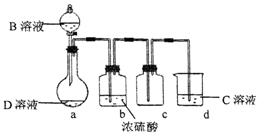
D是很多漂白剂中含有的有效成分,这些产品不能与洁厕灵(含有有机酸和无机酸)一起使用,其原因就是在常温时能发生与反应②相似的反应。某校的学生在实验室利用反应②的原理来制备纯净、干燥的Z2,仪器装置如图所示(夹持固定装置的仪器已略去)。
(4)写出反应②的离子方程式 。
(5)上述实验装置不够完善,改进方法是 。
(14分)
Ⅰ(1)浓H2SO4(1分) (2)S(1分)
(3)
(4)4H2SO4(浓)+K2S→K2SO4+4SO2↑+4H2O(2分)
Ⅱ.(1)第三周期,第IA族;(1分)
(2)2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑(2分)
2NaOH+Cl2↑+H2↑(2分)
(3)ClO-+H2O![]() HClO+OH-(1分)
HClO+OH-(1分)
(4)ClO-+Cl-+2H+=Cl2↑+H2O(2分)
(5)在a、b装置之间加一盛有饱和食盐水的洗气瓶,除去HCl(2分)

 阅读快车系列答案
阅读快车系列答案 2Z
2Z
 (2013?盐城一模)[实验化学]
(2013?盐城一模)[实验化学]
