题目内容
五种短周期元素(用字母表示)在周期表中的相对位置如下,其中Y的单质在空气中含量最高。下列判断正确的是( )
| A.气态氢化物稳定性:X>Y |
| B.最高价氧化物的水化物的酸性:Y>M |
| C.R的氧化物的水化物是离子化合物 |
| D.Z、M、R的原子半径依次减小,最高化合价依次升高 |
BD
解析试题分析: Y的单质在空气中含量最高,则Y元素是N元素,因此根据表中的相对位置可以得出X、Z、M、R分别是C、Al、P、S等元素,因此根据元素周期律可得,气态氢化物Y>X,A错误;最高价氧化物的水化物酸性Y>M,B正确;R的氧化物的水化物可以是H2SO3、H2SO4,因此都是共价化合物,C错误;同周期主族元素原子半径从左至右依次减小,D正确。
考点:本题考查的元素周期表和元素周期律。

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案
相关题目
关于原子或离子结构的下列说法不正确的是
| A.某原子K层上只有一个电子 |
| B.某原子M层上电子数为L层上电子数的4倍 |
| C.某离子M层上和L层上的电子数均为K层的4倍 |
| D.某离子核电荷数与最外层电子数相等 |
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是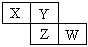
| A.X的气态氢化物比Y的稳定 |
| B.W的最高价氧化物对应水化物的酸性比Z的强 |
| C.Z的非金属性比Y的强 |
| D.X与Y形成的化合物都易溶于水 |
已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是原子半径最小的元素,Y的最高正价与最低负价的代数和为0,Z的二价阳离子与氖原子具有相同的核外电子排布,W原子最外层电子数是最内层电子数的3倍。下列说法正确的是
| A.R的原子半径比Z的大 |
| B.R的氢化物的热稳定性比W的强 |
| C.X与Y形成的化合物只有一种 |
| D.Y的最高价氧化物的水化物的酸性比W的 |
几种短周期元素的原子半径及某些化合价见下表。分析判断下列说法正确的是( )
| 元素代号 | A | B | D | E | G | I | J | K |
| 化合价 | –1 | –2 | +4 –4 | –1 | +5 –3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
A.A的单质能将E单质从KE的溶液中置换出来
B.A、I、J的离子半径由大到小顺序是A>J>I
C.G元素的单质不存在同素异形体
D.J在DB2中燃烧生成两种化合物
元素R的最高价含氧酸分子式为HnRO2n -2 ,则在气态氢化物中,R元素的化合价为
| A.3n-12 | B.3n-6 | C.3n-4 | D.2n-4 |
下列说法中,不符合ⅦA族元素性质特征的是
| A.从上到下原子半径逐渐减小 | B.易形成-1价离子 |
| C.最高价氧化物的水化物显酸性 | D.从上到下氢化物的稳定性依次减弱 |
氯元素在自然界有35Cl和37Cl两种同位素,在计算式:34.969×75.77%+36.966×24.23% =35.453中
| A.75.77%表示35Cl的质量分数 |
| B.24.23%表示35Cl的丰度 |
| C.35. 453表示氯元素的相对原子质量 |
| D.36.966表示37Cl的质量数 |
.我国稀土资源丰富。下列有关稀土元素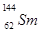 与
与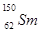 的说法正确的是
的说法正确的是
A.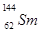 与 与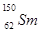 互为同位素 互为同位素 |
B.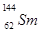 与 与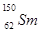 的质量数相同 的质量数相同 |
C.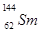 与 与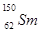 是同一种核素 是同一种核素 |
D.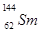 与 与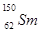 的核外电子数和中子数均为62 的核外电子数和中子数均为62 |