题目内容
【题目】有A、B、C、D、E五种原子序数依次增大的元素(原子序数均不大于30).A的基态原子2p能级有3个单电子;C的核外没有成单电子,B、C两元素形成的化合物晶胞结构如图所示; 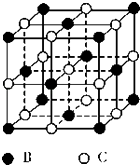
D的3p能级有1个单电子,且与B所在主族相邻;E元 素在地壳中含量居第四位;则:
(1)写出基态E原子的价电子排布式 .
(2)A的最简单氢化物分子的空间构型为 , 其中A原子的杂化类型是 .
(3)B能形成两种常见的单质,其分子式分别为 , 其沸点是同族元素氢化物中最高的因是 .
(4)A和D形成的化合物中,D显正化合价,试写出该化合物与水反应的方程式: .
(5)B、C两元素形成的化合物晶胞结构中,B原子是 堆积(填堆积模型);已知B和C形成的化合物晶体的密度为Pgcm﹣3 , 阿伏加德罗常数为NA , 求晶胞边长a=cm.(用含ρ、NA的计算式表示)
【答案】
(1)3d64s2
(2)三角锥形|sp3
(3)O2、O3|H2O分子间存在氢键
(4)NCl3+3H2O=NH3+3HClO
(5)
【解析】解:由分析可知:A、B、C、D、E五种原子分别为:N元素,O元素,Mg元素,Cl元素,Fe元素;(1)E为Fe元素,Fe是26号元素,其原子核外有26个电子,核外电子排布式为:1s22s22p63s23p63d64s2,价电子排布式为:3d64s2;
故答案为:3d64s2;(2)A的最简单氢化物为NH3,NH3分子中氮原子价层电子对=3+ ![]() =4,且含有一个孤电子对,所以分子空间构型是三角锥形,N原子采取sp3杂化;
=4,且含有一个孤电子对,所以分子空间构型是三角锥形,N原子采取sp3杂化;
故答案为:三角锥形;sp3;(3)B为氧元素,形成的两种单质的分子式为O2、O3,H2O分子间存在氢键沸点较高;
故答案为:O2、O3;H2O分子间存在氢键;(4)A和D形成的化合物为NCl3,Cl显正化合价,NCl3与水反应的方程式为:NCl3+3H2O=NH3+3HClO;
故答案为:NCl3+3H2O=NH3+3HClO;(5)B、C两元素形成的化合物MgO,晶胞中Mg原子处于面心结构,是面心立方堆积;
Mg和O形成的化合物为MgO,由晶胞结构可知,O原子数目8× ![]() +6×
+6× ![]() =4,Mg原子数目1+12×
=4,Mg原子数目1+12× ![]() =4,则晶胞质量=4×
=4,则晶胞质量=4× ![]() =
= ![]() g,晶胞的体积=
g,晶胞的体积= ![]() cm3,故晶胞边长a=
cm3,故晶胞边长a= ![]() cm;
cm;
故答案为: ![]() ;
;
有A、B、C、D、E五种原子序数依次增大的元素(原子序数均不大于30).
A的基态原子2p能级有3个单电子,核外电子排布式为1s22s22p3,则A为N元素;
B、C两元素形成的化合物晶胞结构如图所示,则B、C离子的个数都为4个,化学式为BC,C的核外没有成单电子且原子序数大于A,则B为O元素,C为Mg元素;
D的3p能级有1个单电子,且与B所在主族相邻,核外电子排布式为1s22s22p63s23p5,则D为Cl元素;
E元素在地壳中含量居第四位,则D为Fe元素;
结合题目分析解答.


