题目内容
下表列出了几种常见物质的电离常数或溶度积:
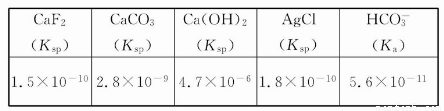
在一定量的0.2 mol/L CaCl2溶液中加入等体积的下列溶液,可以产生沉淀的是( )
A.由水电离出的c(H+)=10-9 mol/L的HF溶液
B.pH=10的氨水
C.1 mol/L的NaHCO3溶液
D.10-9 mol/L的AgNO3溶液
C
【解析】加入等体积的溶液后,CaCl2溶液被稀释。现分别计算如下:A溶液中c(OH-)=10-9 mol/L,则c(H+)=10-5 mol/L,而c(F-)≈c(H+)=10-5 mol/L,混合后,c(F-)<10-5 mol/L,即便是按10-5 mol/L计算,(10-5)2×0.1也小于1.5×10-10,因而无沉淀生成。B中也无沉淀生成,计算方法同上。C中c(HCO3-)≈0.5 mol/L,由于溶液呈碱性,则c(H+)<10-7 mol/L,再根据Ka ,估算c(CO32-)>2.8×10-4 mol/L。而c(Ca2+)·c(CO32-)>0.1×2.8×10-4>2.8×10-9,因而有沉淀生成。同样可分析知D中无沉淀生成。

以黄铜矿(主要成分为CuFeS2,含少量杂质SiO2等)为原料进行炼铜,同时得到副产品绿矾(FeSO4·7H2O)。其主要流程如下:

已知:① 4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O
②部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如表
沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 4.7 | 2.7 | 7.6 |
完全沉淀pH | 6.7 | 3.7 | 9.6 |
(1)试剂a是__________,试剂b是__________。
(2)操作X应为蒸发浓缩、__________、__________。
(3)反应Ⅱ中加CuO调pH为__________,目的是使Fe3+形成Fe(OH)3沉淀,防止生成Cu(OH)2沉淀。
(4)反应Ⅴ的离子方程式为:__________________________________________。