题目内容
【题目】浓度为2.00mol/L的盐酸溶液1L,欲使其浓度变为4.00mol/L,下列方法可行的是( )
A.蒸发掉0.5L水
B.标况下通入44.8L HCl气体
C.将溶液加热蒸发浓缩至0.5L
D.加入10mol/L盐酸0.6L,再将溶液稀释至2L
【答案】D
【解析】解:A.加热蒸发HCl挥发,溶液浓度降低,故A错误;B.标况下的HCl气体44.8L物质的量为2mol,通入1L 2mol/L的盐酸中,溶液中HCl的物质的量为2mol+1L×2mol/L=4mol,但溶液的体积不是1L,故B错误;
C.加热蒸发HCl挥发,溶液浓度降低,故C错误;
C.混合后溶液中的HCl为2mol/L×1L+10mol/L×0.6L=8mol,稀释后混合后HCl的浓度为 ![]() =4mol/L,故D正确,
=4mol/L,故D正确,
故选D.

【题目】硼元素在自然界主要以硼酸.硼酸盐和硼硅酸盐存在.请回答下列问题: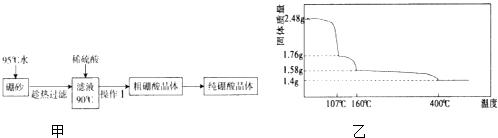
(1)硼元素是ⅢA族的第一个元素,原子结构示意图为 , 天然硼元素有两种稳定同位素10B、11B,其相对原子质量分别为10和11,它们的相对丰度分别为20%和80%,硼元素的平均相对质量为 .
(2)硼酸(H3BO3)是一元弱酸,工业上用硼砂(Na2B4O710H2O)制备硼酸晶体的流程如图甲:
不同温度下硼酸的溶解度见下表:
温度/℃ | 0 | 20 | 40 | 60 | 80 |
溶解度/g | 2.7 | 5.0 | 8.7 | 14.8 | 23.8 |
①写出硼砂溶液和稀硫酸反应的离子方程式 .
②上述流程中获得粗硼酸晶体的操作Ⅰ为、过滤,进一步将粗硼酸晶体提纯的方法是 .
③25℃时0.1mol/L硼酸溶液的pH约为5.1,则其电离常数K约为 .
(3)硼酸在加热过程中发生分解的失重曲线如图乙所示.
①硼酸从开始加热到107℃时,发生反应的化学方程式为 .
②硼酸加热到160℃得到的固体的化学式为 . (B元素的相对原子质量按11计算)
(4)NaBH4由于H元素显﹣1价,具有强还原性,是有机化学上的万能还原剂.在碱性条件下电解NaBO2溶液可以制得NaBH4 , 其反应方程式为NaBO2+2H2O=2O2↑+NaBH4 , 则阴极反应式为 .