题目内容
A、B、C、D、E、F为短周期六种元素,原子序数依次增大,其中A与E同主族且能形成离子化合物EA,B与F同主族,E与F同周期。D的核电荷数是B的最外层电子数2倍,单质F是一种重要的半导体材料。则下列推断中不正确的是 ( )
A.由A、C、D三种元素组成的化合物可以是离子化合物
B.F与D形成的化合物熔点高,可以与某种酸反应
C.原子半径由大到小的顺序是:E>F>C>D
D.五种元素中最高价氧化物对应的水化物酸性最强的是D
D
解析试题分析:据题意可知F为硅,B为碳,D为氧 A为氢,E为钠。
考点:考查非金属元素性质的相关知识点

练习册系列答案
相关题目
下列各组顺序的排列不正确的是( )
| A.原子半径:Na > Mg > Al > H | B.热稳定性: HCl < H2S < PH3 |
| C.酸性强弱:H2SiO3< H2CO3< H3PO4 | D.氧化性:K+ < Na+ < Mg2+ < Al3+ |
已知R2+离子核外有a个电子,b个中子。表示R原子符号正确的是
A.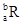 | B.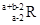 | C.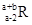 | D.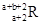 |
下列说法正确的是
| A.Li是最活泼金属,F是最活泼非金属 |
| B.元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行 |
| C.X2+的核外电子数目为18,则X在第四周期第ⅡA族 |
| D.Mg(OH)2碱性比Ca(OH)2强 |
X元素的阳离子与Y的阴离子具有相同的核外电子排布,则下列比较中正确的是( )
| A.原子序数: X<Y | B.原子半径:X<Y |
| C.离子半径:X>Y | D.原子最外层电子数:X<Y |
X、Y、Z、W、M均为短周期元素,X、Y同主族,X的氢化物和最高价氧化物的水化物能反应生成一种离子化合物,其水溶液显酸性;Z、W、M是第3周期连续的三种元素,其中只有一种是非金属,且原子半径Z>W>M。下列叙述准确的是
| A.X、M两元素氢化物的稳定性:X<M |
| B.Z、W、M的氧化物均可做耐高温材料 |
| C.Z是海水中含量最高的金属元素,W是地壳中含量最多的金属元素 |
| D.Z、W、M的单质均能与稀硫酸反应制取氢气,但反应剧烈程度依次减弱 |
下列各分子中所有原子都满足最外层为8电子结构的是
| A.BeCl2 | B.PCl3 | C.PCl5 | D.H2S |
下列说法正确的是
| A.14C和14N质量数相同,互为同位素 |
| B.12C和14N含有相同的中子数 |
| C.12C和 13N中子数相同,质子数不同,互为同位素 |
| D.12CO和14CO物理性质不同,化学性质基本相同 |
如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法正确的是( )
| A.X、Y、Z三种元素最低价氢化物的沸点依次升高 |
| B.由X、Y和氢三种元素形成的化合物中只有共价键 |
| C.物质WY2、W3X4、WZ4均有熔点高、硬度大的特性 |
| D.T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4 |