题目内容
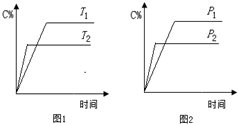 可逆反应A+a BC+2D(a为化学计量数),已知B、C、D为气态物质.反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示.下列说法不正确的是( )
可逆反应A+a BC+2D(a为化学计量数),已知B、C、D为气态物质.反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示.下列说法不正确的是( )| A、T2>T1,p2>p1 | B、该反应为放热反应 | C、若a=2,则A为固态或液态物质 | D、增加B的物质的量,该反应的△H增大 |
分析:根据反应速率的大小确定温度和压强的大小;再根据温度及压强对化学平衡的影响进行判断.
解答:解:A.根据图1,T2时反应时间短,速率快,所以T2>T1;根据图2,P2时反应时间短,速率快,所以 P2>P1,故A正确;
B.根据图1,温度升高,C的百分含量减小,平衡向左移动,所以该反应为放热反应,故B正确;
C.根据图2,压强变大,C的百分含量减小,平衡向左移动,所以反应前气态物质的化学计量数之和小于反应后气态物质的化学计量数之和,故C正确;
D.△H与反应物的量无关,故D错误;
故选D.
B.根据图1,温度升高,C的百分含量减小,平衡向左移动,所以该反应为放热反应,故B正确;
C.根据图2,压强变大,C的百分含量减小,平衡向左移动,所以反应前气态物质的化学计量数之和小于反应后气态物质的化学计量数之和,故C正确;
D.△H与反应物的量无关,故D错误;
故选D.
点评:本题考查外界条件对化学反应速率和化学平衡的影响,题目难度中等.要注意改变固体或液体的量,平衡不移动,△H与反应物的量无关.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
|
对达到平衡状态的可逆反应:A+B
| |
| [ ] | |
A. |
A、B、C是气体,D不是气体 |
B. |
A、B是气体,C、D有一种是气体 |
C. |
C、D是气体,A、B有一种是气体 |
D. |
C、D有一种是气体,A、B都不是气体 |
常温常压下,A、B、C、D均为气体。A与B可发生可逆反应:A+B![]() C+nD。若将2 mol A和2 mol B混合充入体积可变的密闭容器中,在不同条件下达平衡时C的浓度如下:
C+nD。若将2 mol A和2 mol B混合充入体积可变的密闭容器中,在不同条件下达平衡时C的浓度如下:
| 温度/℃ | 压强/Pa | C平衡浓度/mol·L-1 |
| 25 | 1×105 | 1.0 |
| 25 | 2×105 | 1.8 |
| 25 | 3×105 | 3.2 |
| 25 | 4×105 | 6.0 |
(1)该可逆反应中化学计量数n的取值范围为__________,理由是______________。
(2)在5×105 Pa时,D的状态为______________。

 2C B.A+3B
2C B.A+3B