题目内容
用NaHCO3和KHCO3组成的混合物分别与三份同浓度的盐酸进行反应,测得数据如下:
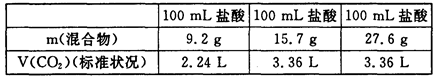
则下列结论中不正确的是 ( )

则下列结论中不正确的是 ( )
| A.盐酸物质的量浓度为1.5 mol/L, |
| B.15.7g混合物与盐酸反应后有剩余 |
| C.加入9.2 g混合物时消耗HCl 0.1 mol |
| D.混合物中NaHCO3和KHCO3的质量比为1 :1 |
D
试题分析:根据给定的数据可知第三份盐过量,盐酸不足量,放出气体的多少按照盐酸来求。根据离子方程式:H++HCO3-=H2O+CO2↑可得n(HCl)=3.36L÷22.4L/mol=0.15mol.所以C(HCl)=0.15mol/0.1L=1.5mol/L.第一份盐酸过量,盐不足量,放出放出气体的多少按照盐来求。假设混合物中NaHCO3和KHCO3的物质的量分别是X、Y,则84X+100Y=9.2;X+Y=0.1.解得X=0.05 Y="0.05" 即NaHCO3和KHCO3是按照1:1混合的。

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案
相关题目
 2HNO3+4N2↑+9H2O中,每生成4 mol N2,转移电子数为10NA
2HNO3+4N2↑+9H2O中,每生成4 mol N2,转移电子数为10NA