题目内容
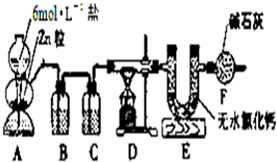 实验室用图所示的实验装置测定FeO和Fe2O3固体混合物中Fe2O3的质量,D装置中的硬质玻璃管中的固体物质是FeO和Fe2O3的混合物.
实验室用图所示的实验装置测定FeO和Fe2O3固体混合物中Fe2O3的质量,D装置中的硬质玻璃管中的固体物质是FeO和Fe2O3的混合物.(1)写出D装置中发生反应的化学方程式
3H2+Fe2O3
2Fe+3H2O,H2+FeO
Fe+H2O
| ||
| ||
3H2+Fe2O3
2Fe+3H2O,H2+FeO
Fe+H2O
.
| ||
| ||
(2)装置B的作用是,装置C中装的液体试剂是
浓硫酸
浓硫酸
.(3)若FeO和Fe2O3固体混合物的质量为23.2g,反应完全后U型管的质量增加7.2g,则混合物中Fe2O3的质量为
16
16
g.(4)U型管E右边又连接干燥管F的目的是,若无干燥管F,则测得Fe2O3的质量将
偏大
偏大
(填:“偏大”、“偏小”或“无影响”).分析:(1)D装置发生的反应是氢气还原氧化亚铁、氧化铁的反应,生成了铁和水;
(2)A中产生的H2中混有HCl和水蒸气,必须通过洗气逐一除去,防止干扰后续实验;
(3)根据氧化铁、氧化亚铁的总质量及U型管的质量增加7.2g为水的质量列式计算;
(4)若无干燥管F,空气中的水蒸气被E吸收则所测生成水的质量增大,氧元素物质的量偏大,Fe2O3的质量也将偏大.
(2)A中产生的H2中混有HCl和水蒸气,必须通过洗气逐一除去,防止干扰后续实验;
(3)根据氧化铁、氧化亚铁的总质量及U型管的质量增加7.2g为水的质量列式计算;
(4)若无干燥管F,空气中的水蒸气被E吸收则所测生成水的质量增大,氧元素物质的量偏大,Fe2O3的质量也将偏大.
解答:(1)装置D中发生的是氧化亚铁、氧化铁与氢气的反应,反应方程式为:3H2+Fe2O3
2Fe+3H2O,H2+FeO
Fe+H2O,
故答案为:3H2+Fe2O3
2Fe+3H2O,H2+FeO
Fe+H2O;
(2)由于A中产生的H2中混有HCl和水蒸气,必须通过洗气逐一除去,防止干扰后续实验,所以B的作用是除去氢气中的氯化氢,C的浓硫酸,用于干燥氢气,
故答案为:除去氢气中的氯化氢;浓硫酸;
(3)U型管的质量增加的7.2g是水,物质的量是
mol=0.4mol,
设FeO、Fe2O3物质的量分别为x、y,则:X+3Y=0.4
根据质量可列式:72X+160Y=23.2
解得Y=0.1,X=0.1,
所以氧化铁的质量为:160g/mol×0.1mol=16g,
故答案为:16;
(4)干燥管F的作用防空气中水蒸气对实验干扰,若无干燥管F,空气中的水蒸气被E吸收则所测生成水的质量增大,导致氧的含量增大,Fe2O3的质量将偏大,
故答案为:偏大.
| ||
| ||
故答案为:3H2+Fe2O3
| ||
| ||
(2)由于A中产生的H2中混有HCl和水蒸气,必须通过洗气逐一除去,防止干扰后续实验,所以B的作用是除去氢气中的氯化氢,C的浓硫酸,用于干燥氢气,
故答案为:除去氢气中的氯化氢;浓硫酸;
(3)U型管的质量增加的7.2g是水,物质的量是
| 7.2 |
| 18 |
设FeO、Fe2O3物质的量分别为x、y,则:X+3Y=0.4
根据质量可列式:72X+160Y=23.2
解得Y=0.1,X=0.1,
所以氧化铁的质量为:160g/mol×0.1mol=16g,
故答案为:16;
(4)干燥管F的作用防空气中水蒸气对实验干扰,若无干燥管F,空气中的水蒸气被E吸收则所测生成水的质量增大,导致氧的含量增大,Fe2O3的质量将偏大,
故答案为:偏大.
点评:本题考查了测定FeO和Fe2O3固体混合物中Fe2O3的质量,是一道综合实验题,解题的关键是掌握各种装置的作用,并能根据相关的数据进行计算,此题对训练学生思维能力有一定帮助,本题难度中等.

练习册系列答案
相关题目
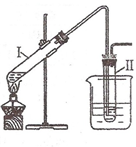 (2008?南京一模)实验室用图所示的装置制取溴乙烷.在试管Ⅰ中依次加入2mL 蒸馏水、4mL浓硫酸、2mL 95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水.加热试管Ⅰ至微沸状态数分钟后,冷却.
(2008?南京一模)实验室用图所示的装置制取溴乙烷.在试管Ⅰ中依次加入2mL 蒸馏水、4mL浓硫酸、2mL 95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水.加热试管Ⅰ至微沸状态数分钟后,冷却.

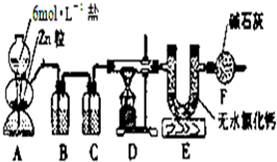 实验室用图所示的实验装置测定FeO和Fe2O3固体混合物中Fe2O3的质量,D装置中的硬质玻璃管中的固体物质是FeO和Fe2O3的混合物.
实验室用图所示的实验装置测定FeO和Fe2O3固体混合物中Fe2O3的质量,D装置中的硬质玻璃管中的固体物质是FeO和Fe2O3的混合物.