题目内容
将9.0 g铜和铁的混合物投入100mL稀硝酸中,充分反应后得到标准状况下1.12L NO,剩余4.8 g金属;继续加入100mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下1.12L NO。若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法正确的是( )
| A.原混合物中铜和铁各0.075mol |
| B.稀硝酸的物质的量浓度为0.5mol·L-1 |
| C.第一次剩余4.8g金属为铜和铁 |
| D.再加入上述100mL稀硝酸,又得到标准状况下1.12L NO |
A
试题分析:A、分析题意可知,反应中硝酸与合金正好反应完全,铁转化为二价铁离子。假设n(Cu)=xmol;
n(Fe)=ymol;Cu-2e-=Cu2+;Fe-2e-=Fe2+
依题意有:64x+56y=9(质量关系);2x+2y=0.3(电子得失相等)
x=0.075mol;y=0.075mol,正确;
B、稀硝酸的物质的量浓度为
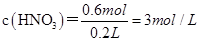 ,错误;
,错误;C、混合物中各自的质量分别为:m(Fe)=4.2g;m(Cu)=4.8g,因此第一次剩余4.8g金属为铜,错误;
D、再加入100mL稀硝酸,发生如下的反应:
3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
由以上方程式可知,生成的气体为三价铁离子物质的量的三分之一:0.0025mol,标况下的体积为:0.056L。错误。

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案
相关题目
 Cu3P2+3H2而增重4.96 g;第二支玻璃管反应后质量减轻了5.76 g。
Cu3P2+3H2而增重4.96 g;第二支玻璃管反应后质量减轻了5.76 g。 代表阿伏加德罗常数),不正确的是
代表阿伏加德罗常数),不正确的是 2HNO3+4N2↑+9H2O中,每生成4 mol N2,转移电子数为10NA
2HNO3+4N2↑+9H2O中,每生成4 mol N2,转移电子数为10NA CO2+2H2O+4Cu。当CH4完全反应后,硬质玻璃管的质量减轻4.8克。将该反应后产生的气体通过过量澄清石灰水中,充分吸收,生成沉淀8.5克。
CO2+2H2O+4Cu。当CH4完全反应后,硬质玻璃管的质量减轻4.8克。将该反应后产生的气体通过过量澄清石灰水中,充分吸收,生成沉淀8.5克。 LHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是
LHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是 mo1·L-1
mo1·L-1 mol·L-1
mol·L-1 mol·L-1
mol·L-1 mol·L-1
mol·L-1